ORBITE ÉLECTRONIQUE
|
Un PROTON relativement immobile attire un ÉLECTRON qui passe à proximité. Celui-ci poursuit sa course vers ledit PROTON en accélérant sa vitesse sans que son énergie cinétique (Ec) ne dépasse son énergie interne (Ee), selon l'effet Compton. Ec ≤ Ee → Ec max = Ee |
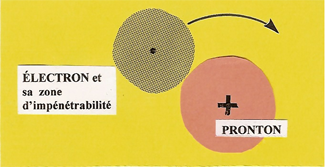 |
L'ÉLECTRON ne se mêle pas au PROTON parce qu'il est entouré d'une atmosphère qui définit une zone d'impénétrabilité.
Ainsi protégé, l'ÉLECTRON ne heurte pas directement la lourde masse du PROTON mais roule à sa surface et s'enroule autour alors que son bouclier décrit un disque de valence.
EXEMPLE DE L'HYDROGÈNE
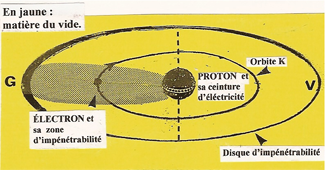 |
Lorsqu'un ÉLECTRON tourne autour d'un PROTON devenu le NOYAU d'un ATOME d'HYDROGÈNE, sa sphère d'impénétrabilité, en circonvolution autour dudit NOYAU, s'aplatit. |
|
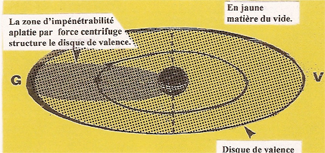
La zone d'impénétrabilité aplatie par la force centrifuge structure un disque de valence dont le rayon (Rv) donne la mesure extérieure de l'atome. |
 |
 |
Vue en coupe du disque de valence de L'ATOME D'HYDROGENE. |
|
André JULG, Professeur à l'Université d'Aix, dans UNIVERSALIS, (Liaisons chimiques) définit les limites extérieures de l'atome comme étant celles d'une zone d'impénétrabilité dont le rayon (Rv) est de (1,2 Å) pour l'Hydrogène, de (1,5 Å) pour l'Azote, de (2 Å) pour le Brome, etc. |
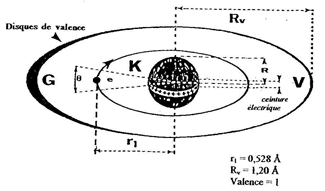 |
La zone d'impénétrabilité de l'atome d'Hydrogène, c'est-à-dire son disque de valence de rayon (Rv = 1,2 Å), possède deux arcs : l'un (G), de forte résistance face à l'électron ; l'autre (V), de moindre résistance, diamétralement à l'opposé du premier. Ces arcs tournent en même temps que l'électron.
Alors que l'unité (q+) de charge électrique d'un PROTON habille toute la surface de son volume, lorsqu'un ÉLECTRON tourne autour, par attraction celui-ci rassemble l'unité (q+) en une ceinture dans le plan de l'orbite électrique et dans le volume du disque de valence.
LES ORBITES PERMISES DE L'ATOME D'HYDROGÈNE
L'égalité entre la force centrifuge et la force électrostatiqueMe . (vn)2 / rn = K . q2 / (rn)2 = 2,3 . 10-28 / (rn)2(vn)2 = 253 / rn (1)
L'accord de phase entre l'onde cinétique et le cycle orbital2 . π . rn = n . h / (me . vn) = → vn = 1,157 . 10-4 n / rn(vn)2 = 1,34.10-8 n2 / (rn)2 (2)
Les formules 1 et 2 impliquent : rn = 5,296.10-11 n2 (3)
|
Energie électrostatique Energie cinétique Energie globale en introduisant (3) |
U = - 2,3 . 10-28 / rn Ec = me . v2n / 2 = 2,3 . 10-28 / (2 . rn) U + Ec = - 2,3 . 10-28 / (rn . 2) = U + Ec = - 2,17 . 10-18 / n2 = 13,6 / n2 en eV |
Niveaux d'énergie de l'Hydrogène :
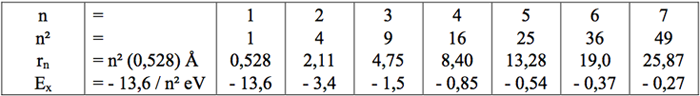
Dans un atome stable d'hydrogène, l'ÉLECTRON gravite sur l'orbite fondamental de rayon (r1 = 0,528 Å).
Lorsqu'un projectile heurte l'ÉLECTRON de l'orbite (r1) d'un atome d'hydrogène et lui communique une énergie (Ex) selon l'intensité de celle-ci on a :
- si Ex > Ei = 13,6 eV (énergie d'ionisation ou de sortie), l'ÉLECTRON est expulsé hors de l'atome avec une vitesse (v) définie par la relation : Ex = Ei + (me . v2 / 2)
- si Ex < Ei, c'est le cas d'un ÉLECTRON expulsé de son orbite fondamentale de rayon (r1) sur une autre, quelconque, de rayon (rx) et qui, en moins de 10-10 seconde, se cale sur l'orbite intermédiaire la plus proche de rayon (rn) et d'énergie (En), puis tombe, généralement moins de 10-7 seconde après, sur une orbite plus interne et finalement sur l'orbite fondamentale de rayon (r1) ou il se stabilise. Au cours de ce phénomène, il y a émission d'un photon dont l'énergie est égale à
ΔE = En - E1
Exemple dessin ci-dessous : - 0,85 + 3,4 = 2,55 eV
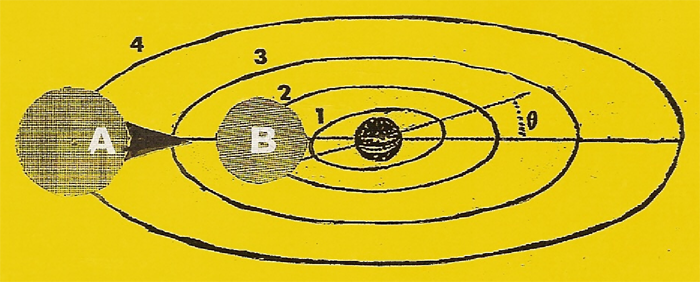
Les physiciens on cru que l'ÉLECTRON se stabilisait sur l'orbite fondamentale de rayon (r1) pour satisfaire la formule [rn = n2. (0,528) Å] dans laquelle il n'y a pas d'entier inférieur à (n = 1). En réalité si l'ÉLECTRON n'était pas protégé par sa zone d'impénétrabilité il tomberait sur le noyau.
Cest donc le rayon de cette zone d'impénétrabilité qui défini le rayon (r1) dit fondamental.
Dans les ATOMES complexes, les ÉLECTRONS se répartissent sur des orbites groupées en plusieurs niveaux : (K, L, M, N, O, P, Q), ou ils exercent, comme sur le dessin ci-dessous, trois fonctions distinctes :
A Les ÉLECTRONS de valence occupent chacun une orbite différente et génèrent un disque de valence capable de se lier au disque de valence d'un autre ATOME
|
Par exemple les orbites (L1 et L2) sur lesquelles gravitent les ÉLECTRONS (3 et 4) se prolongent par deux disques de valence visibles sur le schéma ci dessus. Ils ont chacun deux arcs l'un (V) dit de valence, de faible résistance pour le même arc d'un autre ATOME qui voudrait s'y joindre ; l'autre (G) de grande résistance face à un ATOME qui voudrait s'y joindre. |
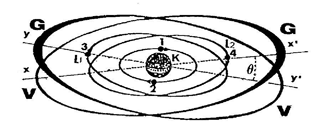 |
B - Les ÉLECTRONS de structure, deux par deux saturent l'orbite sur laquelle ils sont en opposition de phase. Cette orbite saturée ne peut plus se lier à celle d'un autre atome, mais devient un élément de structure de l'atome. Par exemple, les ÉLECTRONS (1 et 2) saturent l'orbite (K) qui se prolonge par un disque de structure (non représenté sur le dessin, par obligation de simplicité).
C Les ÉLECTRONS passifs, représentés sur le dessin ci-dessous, n'ont aucune fonction dans l'atome si ce n'est de compenser une unité (q+) de la charge électrique nucléaire. Ces ÉLECTRONS passifs glissent entre les disques de structure des niveaux inférieurs :- au niveau (M), on peut en compter jusqu'à 10- aux niveaux (N et O), jusqu'à (10 + 14)
La représentation ci-dessous est celle d'atome complex :
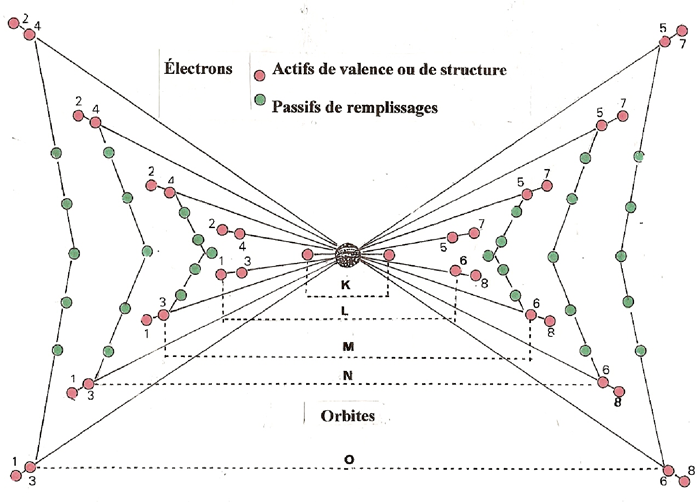
Le nombre maximal de liaisons chimique ou valence d'un atome varie de 1 à 4 certains en ont plus mais ceux en excédent sont utilisés en liaison double.

