Liaisons entre molécules
Lien peptidique (covalente)
EFFET PEPTIDIQUE
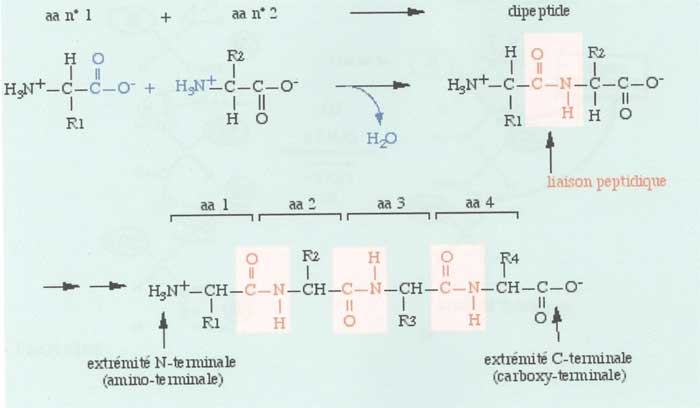
une liaison peptidique est une liaison covalente. Elle résulte de la réaction entre la fonction carboxyle (COOH) d'un premier acide aminé et la fonction amine du deuxième, avec comme produit secondaire une molécule d'eau (H2 O).
Soit deux molécules n° 1 + n° 2 : Lorsque la molécule (n° 1), dont l'une des extrémités est de la forme (C - O2-), rencontre la molécule (n° 2) possédant une extrémité (H3 - N+), il y a formation d'une liaison covalente par processus peptidique entre (N et C) et élimination d'une molécule d'eau (H2O) (Figure ci-dessous).
(C - O2) + (H2 - N+) &rarr ; (C - N) + H2O
Dans la nouvelle molécule (protéine), l'une des extrémités porte le groupe (H3N+), amino-terminal ; l'autre, le groupe (COO-), dit carboxy-terminal. Mises à part les deux extrémités, on note que la création d'une liaison par processus peptidique fait disparaître les charges intermédiaires.
D'une façon plus générale, lorsqu'une extrémité (H O) d'une molécule est en présence de l'extrémité (H) d'une autre molécule, il se crée une liaison moléculaire dit peptidique entre les deux molécules avec éjection de (H2O).
En voilà un second exemple, celui des Nucléotides (Figure ci-dessous) :
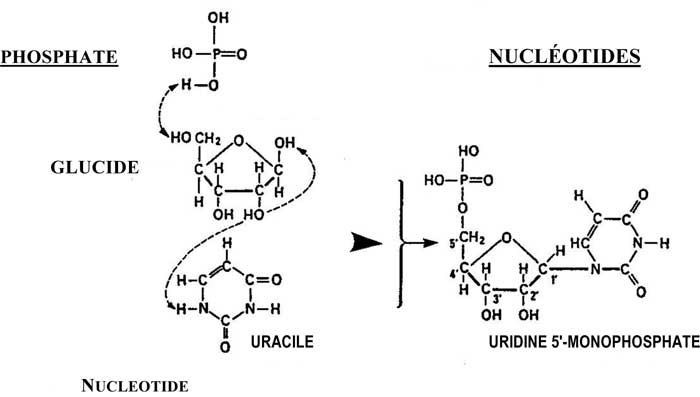
Les liaisons peptidiques sont fondamentales dans la formation des peptides, des polypeptides et des protéines.
Ponts hydrogènes (non covalents)
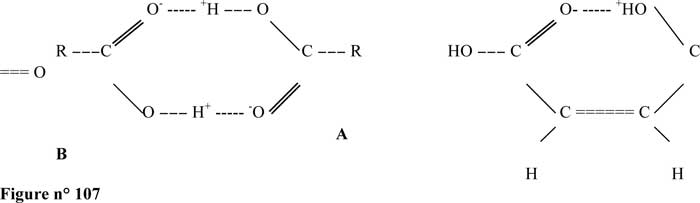
Un pont hydrogène (représenté par une suite de points) est une liaison non covalente. Elle relie des molécules en impliquant un atome d'hydrogène :
Ainsi H2O . . . H- O- O ou C = O . . . H- O- H
Nous les avons mentionnées à propos de l'eau, mais elles Sont avant tout des liaisons biologiques, car elles peuvent se tordre, se rompre ou se restaurer à la température de 27° ; Celsius. Cette propriété donne aux architectures moléculaires assemblées par liaisons hydrogène, souplesse et possibilité d'évoluer à la température ambiante, ce que ne peuvent faire les liaisons covalentes, beaucoup trop énergétiques et donc complètement rigides à cette même température. Or, cette souplesse et ces possibilités d'évolution sont indispensables aux molécules biologiques.
La liaison hydrogène correspond à une énergie de quelques dizaines de kJ/mol, soit dix fois plus que pour une liaison de Van der Waals, mais dix fois moins que pour une liaison covalente.