ATOMES de référence et leurs isotopes.
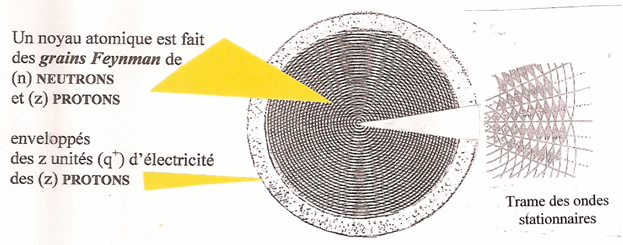
Un NOYAU atomique est réellement fait de (z) PROTONS et (n) NEUTRONS, c'est-à-dire (A = z + n) NUCLEONS qui ont mêlé leurs grains Feynman dans un volume dont l'enveloppe est constituée des (z) unités d'électricité (q+) des (z) protons.
Les nucléons (protons et neutrons) ne sont présents dans le noyau que par leur masse en grains Feynman dilués dans le volume nucléaire. Il n'est plus question de la non stabilité des neutrons et de la répulsion des protons entre eux. Le noyau est naturellement stable.
Si l'on constate un défaut de masse (da), c'est qu'au cours de ses diverses transformations le noyau, tout simplement, a perdu un nombre correspondant de grains Feynman.
La masse réelle (ma) d'un atome se mesure en unité de masse (Eu = 931,481 MeV) et correspond à la relation [ma c² = Ea = (A + da) Eu] où (A) est le nombre nucléaire, c'est-à-dire l'unité la plus proche de [(Ea / Eu = (A + da).
Selon la découverte achevée de Broglie : la capacité énergétique (Ea) d'un noyau atomique stable est liée à une capacité à osciller sur la fréquence
(fo = Ea / h = 2,269 1023 ou l'une de ses harmoniques)
Le noyau excité de l'intérieur par l'oscillation sur la même fréquence (fo) des grains Feynman oscille sur la dite fréquence et, comme dans une cavité résonante forment des ondes stationnaires en forme d'alvéoles qui sous-tendent la structure nucléaire.
Tous les atomes qui auraient pu se créer avec un mode de résonance différent de (fo) étaient instables et se sont immédiatement désagrégés.
Un élément chimique est défini par le nombre (z) des charges électriques (q+) qui entoure son noyau mais parmi tous les atomes stables d'un même élément chimique ceux appelés isotopes diffèrent par le nombre de leurs NEUTRONS qui doit rester voisin du nombre (z) des charges électriques (q+) au-delà l'isotope devient rapidement instable. Mais peut se rétablir après l'émission d'un rayonnement α, β- ou β+.
Pour un même élément chimique l'isotope qui présente le plus grand nombre d'atome est dit “de référence”
Aujourd'hui, les physiciens ont recensé 118 atomes stables et instables. Mais ceux présents sur terre se répartissent en (92) éléments chimiques, chacun enveloppé d'une membrane faite d'un nombre (z de 1 à 92) d'unités (q+) d'électricité. Deux radioactifs ont disparu : le TECHNITIUM (z = 43), le PROMETHIUM (z = 61) ; tous les autres au-dessus de (z = 83) sont radioactifs et ont quasiment disparu, sauf le THORIUM (z = 90) et l'URANIUM (z = 92), qui ont des périodes de plusieurs millions d'années.
Tableau Périodique des éléments :
Pour accéder à l'une des espèces atomiques cliquez sur son numéro
| Métalloïdes | Non-métaux | Non-métaux | Gaz nobles |
| Métaux alcalins | Métaux alcalino-terreux | Métaux de transition | Métaux pauvres |
| Lanthanides | Actinides |
1 - L'ATOME d'hydrogène
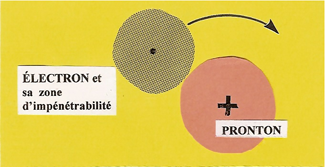 |
Il possède la structure la plus simple. Son NOYAU n'est autre qu'un PROTON habillé d'une seule unité (q+) d'électricité Protégé par sa zone d'impénétrabilité qui agit comme un bouclier, L'ÉLECTRON attiré par le PROTON ne s'y écrase pas, il s'enroule sur une orbite (K), à une vitesse de 2.200 Km/s. |
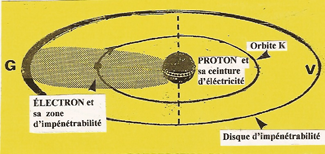 |
A cette vitesse la zone d'impénétrabilité, sous l'action de la force centrifuge, se contracte sur le rayon de l'orbite électronique. |
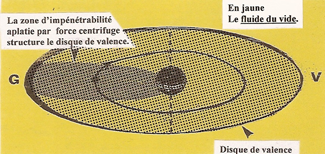 |
Dans son mouvement circulaire la zone d'impénétrabilité crée un disque de valence apte à se lier avec le disque d'un autre ATOME. |
|
Représentation en coupe du disque de valence sur lequel on remarque un arc (G) de forte résistance à toute pénétration, alors que l'arc (V) dit de VALENCE permet une liaison avec un disque identique d'un autre ATOME. |
 |
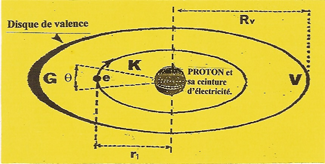 |
Autres caractéristiques de l'ATOME d'Hydrogène :e = ÉLÉCTRONR v= 1,20 År1 = 0,528Å |
L'ATOME d'hydrogène (H) est constitué d'un NOYAU qui n'est autre qu'un PROTON, autour duquel tourne un ÉLÉCTRON dont l'orbite (K) est prolongée par un disque de valence.
| Caractéristiques | z = 1 | Masse = 1,00797 um |
| ÉLÉCTRONS de valence | = 1 (K) |
| Isotopes : | deutérium 2H | masse : 2,0135 um | stable |
| Tritium 3H | masse : 3,016 um | radioactif : 12 ans |
2 - L'ATOME d'hélium
C'est le deuxième dans la liste de Mendeleiev. Son NOYAU est habillé de deux unités (q+) d'électricité. C'est un gaz rare
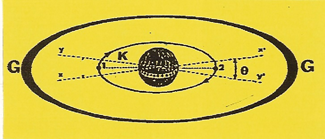 |
Protégé par sa zone d'impénétrabilité, le premier ÉLÉCTRON attiré par le NOYAU ne s'y écrase pas. Il s'enroule sur l'orbite (K). On retrouve la structure de l'ATOME d'hydrogène sauf que ce premier ÉLÉCTRON ne compense qu'une seule unité (q+) d'électricité sur les deux que compte le ceinture nucléaire. |
Le second ÉLÉCTRON ne percevra la charge résiduelle (q+) de la ceinture nucléaire qu'à travers l'angle (ϑ) et viendra se placer en (2) diamétralement à l'opposé du premier ÉLÉCTRON sur la même orbite
Les deux ÉLÉCTRONS (1 et 2) en opposition de phase sur la même orbite saturent celle-ci et le disque, qui la prolonge, présente deux arcs (G) de grande résistance et aucun arc (V) de moindre résistance. Ce disque qui ne peut se lier à aucun autre est dit de structure. L'Hélium est un ATOME inerte.
Caractéristiques de l'hélium (He) z = 2
| ÉLÉCTRON valence | = 0 | masse = 4,0026 um |
| Disque saturé | = (K) |
| Isotopes : | 3He | masse = 3,016 um | stable |
| 6He | masse = 6,01889 um | radioactif 0,806 s |
Attention : 1 disque de structure contient 2 ÉLÉCTRONS qui neutralisent deux unités (q+) d'électricité du NOYAU et constitue un élément de l'édifice atomique.
3 - L'ATOME de lithium
Il compte, sur son NOYAU trois unités d'électricité. C'est un alcalin.
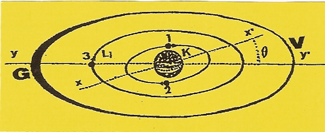 |
Comme dans le cas de l'hélium, les deux premiers ÉLECTRONS occupent et saturent l'orbite (K) mais ne compensent pas les trois unités (q+) d'électricité de la ceinture nucléaire. Lorsqu'un troisième ÉLECTRON se présente, attiré par la charge résiduelle (q+) il ne peut percevoir celle-ci que sur l'un des plans passant par les axes (xx') ou (yy') qui forment entre eux un angle (ϑ) |
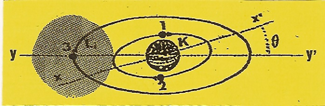 |
Imaginons que le troisième ÉLECTRON se présente sur le plan passant par l'axe (yy') et se cale sur cet axe, de telle sorte qu'il décrive une orbite (L1).et que sa zone d'impénétrabilité roule sur l'orbite (K). |
En faisant abstraction de la première orbite de structure (K) saturée par les ÉLECTRONS (1 et 2), l'ATOME de lithium avec son troisième ÉLECTRON dont l'orbite (L1) se prolonge par un disque de valence, possède une structure qui rappelle celle de l'hydrogène.
Caracteristiques du lithium : (7Li) z = 3
| ÉLÉCTRON valence | = 1 (L) | masse = 6,941 um |
| Disque sature | = (K) |
| Isotopes : | 6Li | masse = 6,01889 um | radioactif : 7,5 ms |
| 8Li | masse = 8,01889 um | radioactif : 0,838s |
4 - L'ATOME de béryllium
Il possède quatre unités (q+) d'électricité sur son NOYAU. Cest un métal alcalino-terreux.
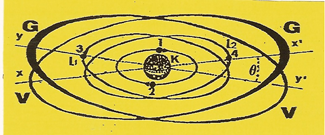 |
Les 2 premiers ELECTRONS se placent en opposition de phase sur l'orbite (K) Le troisième étant sur l'orbite (L1) passant par le plan (yy'), lorsque le quatrième se présente, attiré par la charge résiduelle (q+) de la ceinture nucléaire, il ne peut en subir l'effet attractif que sur l'axe (xx'). Il s'y place de facon que sa zone d'impénétrabilité roule sur l'orbite (K) et que lui-même décrive l'orbite (L2) diamétralement à l'opposé du troisième ELECTRONS. |
Les quatre ELECTRONS s'équilibrent électriquement entre eux et avec le noyau, comme indiqué sur la Figure. Les deux orbites (L1 et L2) se prolongent par deux disques de valence ; l'atome de Béryllium est bivalent et possède un disque de structure (K).
Caracteristiques du béryllium : ( 9Be ) z = 4
| ÉLÉCTRON valence | = 2 (L) | masse = 9,012 um |
| Disque sature | = (K) |
| Isotopes : | 7Be | masse = 7,01692 um | radioactif : 53,12 j |
| 10Be | masse = 10,0135 um | radioactif : 1,51 106 ans |
5 - L'ATOME de bore
Il possède cinq unités (q+) d'électricité sur son NOYAU. C'est un métalloide
Remarque : Pour simplifier le dessin de l'atome de bore et des suivants, les disques de valence ne seront plus représentés, mais on peut les imaginer dans le prolongement des orbites (L1, L2 et L3).
Les quatre premiers ELECTRONS s'équilibrent comme dans le cas précédent,sauf qu'ils ne compensent que quatre unités (q+) de la charge nucléaire
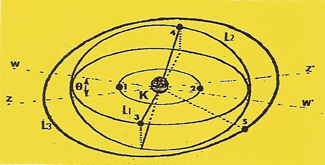 |
Lorsqu'un 5ème ELECTRONS se présente, attiré par la charge résiduelle de la ceinture nucléaire, il ne peut en subir l'attraction qu'à l'extérieur de l'angle (ϑ) formé par les axes (ww'), et (zz'). De sorte qu'il se place en équilibre électrostatique en (5) sur l'orbite (L3) qui se prolonge par un disque de valence. Avec ses trois disques de valence le bore est trivalent. |
Caracteristiques du bore : ( 11B ) z = 5
| ÉLÉCTRON valence | = 3 (L) | masse = 10,811 um |
| Disque sature | = (K) |
| Isotopes : | 10B | masse = 10,01293 um | stable |
| 12B | masse = 12,01435 um | stable |
6 - L'ATOME de carbone
Il possède six unités (q+) d'électricité sur son NOYAU. C'est un non métallique.
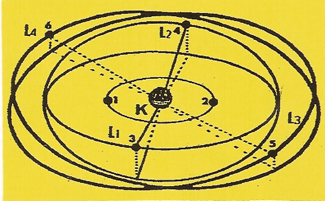 |
Les cinq premiers ELECTRONS se répartissent comme dans le cas du bore, lorsque le sixième se présente, attiré par la charge, résiduelle (q+) de la ceinture nucléaire, il ne peut se caler qu'en six sur l'orbite (L4) en équilibre électrostatique avec son environnement. Dans le prolongement de chacune des orbites (L1, L2, L3 et L4) sur lesquelles ne gravite qu'un seul électron, Il se crée un disque de valence. Dans ces conditions, l'atome de Carbone est quadrivalent. |
Il peut arriver que le sixième ELECTRONS vienne se placer diamétralement, à l'opposé du cinquième, sur la même orbite (L3) qu'il sature. Le disque correspondant devient un disque de structure. Dès lors, l'atome de Carbone est bivalent.
Caracteristiques du carbone : ( 12C ) z = 6 masse = 12 um
| ÉLÉCTRON valence | = 4, | ou 2(L) |
| Disque sature | = (K) | ou (K+1L) |
| Isotopes : | 13C | masse = 13,0033 um | stable |
| 14C | masse = 14,00324 um | radioactif : 5730 ans |
7 - L'ATOME d'azote
Il possède sept unités (q+) d'électricité sur son NOYAU. C'est un non métallique.
Les six premiers ELECTRONS s'équilibrent comme dans le cas précédent (carbone),
Lorsqu'un septième ÉLECTRON se présente, attiré par la charge électrique résiduelle de la ceinture nucléaire, il se cale sur l'orbite (L1) en opposition avec le premier occupant (4) et la sature. L'atome d'azote est trivalent et possède deux disques de structures (K et L1)
Il arrive que le septième électron, au lieu de se caler en opposition de phase avec un précédent occupe une nouvelle orbite (L) plus externe et crée un nouveau disque de valence. Dans ce cas, l'azote possède cinq valences et ne compte qu'un disque de structure (K).
Caracteristiques de l'Azote : ( 14N ) z = 7 masse = 14,0067 um
| ÉLÉCTRON valence | = 3(L), | ou (4L+1M) |
| Disque sature | = (K)+1(L) | ou (K) |
| Isotopes : | 13N | masse = 13,0057 um | radioactif : 9,96 j |
| 15N | masse = 15,0001 um | stable | |
| 16C | masse = 16,0061 um | radioactif : 7,15 s |
8 - L'ATOME d'Oxygène
ATTENTION, la figure ci-dessous comporte 10 ÉLECTRONS, c'est-à-dire qu'elle est valable pour cet ATOME et les 2 qui suivent.
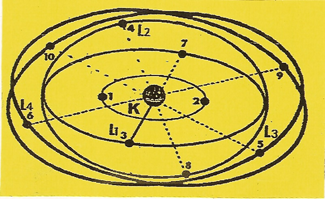 |
Le septième ÉLECTRON s'étant calé en opposition de phase sur l'orbite (L1) qui se trouve saturée, le huitième ne peut prendre place que sur l'une des trois autres orbites non saturée, soit (L2) qui, à son tour, est saturée. Il ne reste à l'ATOME d'OXYGÈNE que deux orbites non saturées (L3 et L4) ; il est donc bivalent et compte trois disques de structure (K, L3 et L4) |
Caracteristiques de l'oxygene : ( 16O ) z = 8 masse = 15,9994 um
| ÉLÉCTRON valence | = 2 |
| Disque sature | = (K)+2(L) |
| Isotopes : | 17O | masse = 16,999 um | stable |
| 18O | masse = 17,9999 um | stable |
9 - L'ATOME de Fluor
Il possède neuf unités (q+) d'électricité sur son NOYAU. C'est un halogène.
Selon le processus précédent, le neuvième ELECTRON se cale sur l'une des deux orbites (L3 ou L4), en opposition de phase avec le premier occupant et la sature, de sorte que l'atome de fluor est univalent et compte quatre disques de structure (K, L1, L2 et L3).
Caracteristiques du fluor : ( 19F ) z = 9 masse = 18,9984 um
| ÉLÉCTRON valence | = 1(L) |
| Disque sature | = (K)+3(L) |
| Isotopes : | 18F | masse = 18,00093 um | radioactif : 1,829 h |
10 - L'ATOME de Néon
Il possède dix unités (q+) d'électricité sur son NOYAU. C'est un gaz rare.
Le dixième ELECTRON sature la dernière orbite. Le Néon est sans disque de valence et n'a donc pas la possibilité de se lier avec un autre atome. En revanche, il compte cinq disques de structure (K, L1, L2, L3 et L4).
Remarque : Les paires d'électrons (1, 2), (3, 7), (4, 8), (5, 10) et (6, 9) se répartissent en fonction des forces répulsives qui s'établissent entre eux et le NOYAU.
Caracteristiques du Néon : ( 20Ne ) z = 10 masse = 20,179 um
| ÉLÉCTRON valence | = 0 |
| Disque sature | = ( K + L ) |
| Isotopes : | 21Ne | masse = 20,993 um | stable |
| 22Ne | masse = 21,991 um | stable |
11 - L'ATOME de sodium
Il possède onze unités (q+) d'électricité sur son NOYAU. C'est un métal alcalin.
Le dessin ci-dessous est relatif à cet ATOME et au suivant.
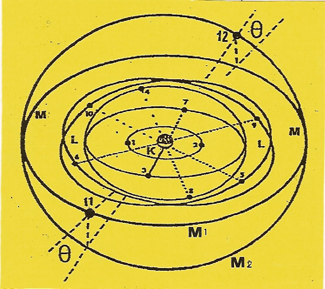 |
Les dix premiers ELECTRONS s'équilibrent comme dans le cas du néon.Lorsque le onzième se présente, attiré par la charge électrique résiduelle de la ceinture nucléaire, il ne peut en subir l'attraction que sur l'une des orbites (M) qui font entre elles un angle (ϑ).Il se place par exemple en (11) sur (M1). Le sodium est univalent et compte, comme les trois atomes qui suivent cisix disques de structure. |
Caracteristiques du Sodium : ( 23Na ) z = 11 masse = 28,086 um
| ÉLÉCTRON valence | = 1(M) |
| Disque sature | = ( K + L ) |
| Isotopes : | 22Na | masse = 21,994 um | radioactif : 2,6 ans |
12 - L'ATOME de Magnésium
Il compte treize unités (q+) d'électricité sur son NOYAU. C'est un alcalino-terreux.
Lorsque le douzième ÉLECTRON se présente, il trouve sa place sur la seconde orbite (M2) faisant un angle (ϑ) avec la première, mais de l'autre coté par rapport au onzième ÉLECTRON. Le magnésium est bivalent.
Caracteristiques du Magnesium : ( 24Mg ) z = 12 masse = 24,305 um
| ÉLÉCTRON valence | = 2(M) |
| Disque sature | = ( K + L ) |
| Isotopes : | 25Mg | masse = 24,9858 um | stable |
| Isotopes : | 26Mg | masse = 25,9820 um | stable |
Le dessin ci-dessous est relatif aux ATOMES de 13 à 18 ÉLECTRONS. Nous y avons joint un schéma simplifié.
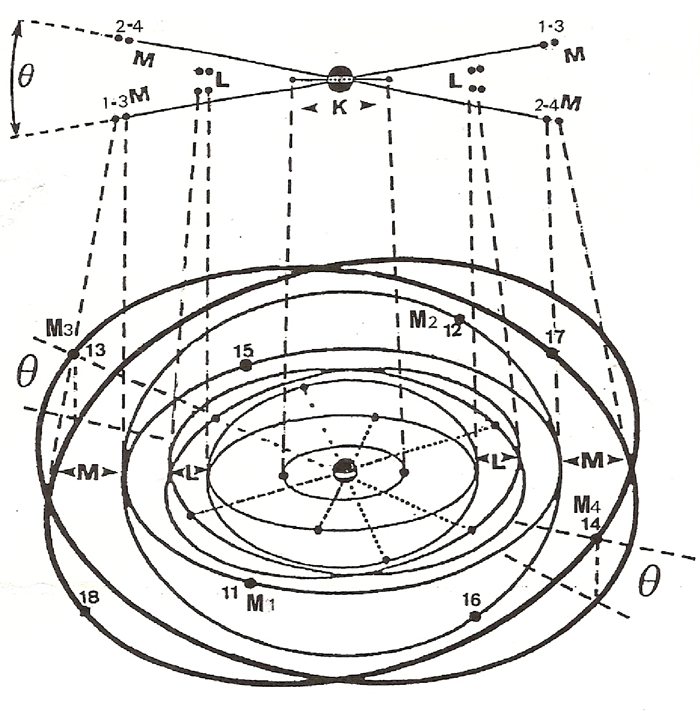
13 - L'ATOME d'Aluminium
Il compte treize unités (q+) d'électricité sur son NOYAU. C'est un métal.
Le treizième ELECTRON se cale sur une troisième orbite (M3) sur l'un des axes (xx') ou (yy'), soit en (13), ou il engendre un troisième disque de valence. L'ATOME d'Aluminium est trivalent.
Caracteristiques du Aluminium : ( 27Al ) z = 13 masse = 28,086 um
| ÉLÉCTRON valence | = 3(M) |
| Disque sature | = ( K + L ) |
| Isotopes : | 26Al | masse = 25,9868 um | radioactif :717000 ans |
14 - L'ATOME de Silicium
Il compte quatorze unités (q+) d'électricité sur son NOYAU. C'est un métalloide.
Le quatorzième ELECTRON se place sur l'axe (yy') sur la quatrième orbite du niveau (M4). L'atome de silicium possédant quatre orbites non saturées au niveau (M) est quadrivalent.
Caracteristiques du Silicium : ( 28Si ) z = 14 masse = 28,086 um
| ÉLÉCTRON valence | = 4(M) |
| Disque sature | = ( K + L ) |
| Isotopes : | 29Si | masse = 28,9979 um | stable |
| 30Si | masse = 29,974 um | stable | |
| 32Si | masse = 31,974 um | radioactif : 172 ans |
15 - L'ATOME de Phosphore
Il compte quinze unités q+) d'électricité sur son NOYAU. C'est un métal.
Le quinzième ELECTRON se cale en phase sur l'une des orbites (M1), déjà occupée par un précédent et la sature ; le phosphore est trivalent et compte six disques de structure (K, L1, L2, L3, L4 et M1).
Parfois, comme dans le cas de l'azote, le quinzième ÉLECTRON garde son indépendance sur une orbite plus excentrée et l'azote possède cinq disques de valence et un disque de structure en moins.
Caracteristiques du Phosphore : ( 31P ) z = 15 masse = 30,9738 um
| ÉLÉCTRON valence | = 3(M) | ou (4M + 1N) |
| Disque sature | = ( K + L )+ 1M | ou (K + L) |
Aucun isotope
16 - L'ATOME de Souffre
Il compte seize unités (q+) d'électricité sur son NOYAU. C'est un non métal.
Le seizième ELECTRON se cale sur l'orbite (M2) qu'il sature. L'ATOME de Soufre est bivalent et compte sept disques de structure (K, L1, L2, L3, L4, M1 et M2). Il arrive que ce seizième ÉLECTRON garde son indépendance sur une orbite plus externe (M)et l'ATOME de soufre est quadrivalent. Plus rarement, les quinzième et seizième ELECTRONS occupent des orbites isolées plus externes (N) et les atomes ont 6 disques de valence, avec chacun un arc de moindre résistance.
Caracteristiques du Souffre : ( 32S ) z = 16 masse = 32,064 um
| ÉLÉCTRON valence | = 2(M) | ou 4(M) | ou (4M + 2N) |
| Disque sature | = (KL)+(2M) | ou (KL + 1M) | ou (KL) |
| Isotopes : | 33S | masse = 32,971 um | stable |
| 34S | masse = 33,9678 um | stable | |
| 35S | masse = 34,969 um | radioactif : 87,32 j | |
| 36S | masse = 35,967 um | stable |
17 - L'ATOME de Chlore
Il compte dix-sept unités (q+) d'électricité sur son NOYAU. C'est un Halogène.
Comme dans le cas précédent, les sept ELECTRONS du niveau (M) peuvent, selon l'environnement, rester isolés ou se grouper deux par deux, ou encore occuper une ou plusieurs orbites du niveau (N) de telle sorte que le Chlore présente 1, 3, 5 ou 7 disques de valence..
Caracteristiques du Chlore : ( 35Cl ) z = 17 masse = 35,453 um
| ÉLÉCTRON valence | = 1(M) | ou 3(M) | ou (4M + 2N) | ou (4M + 3N) |
| Disque sature | = (KL)+(3M) | ou (KL + 2M) | ou (KL) | ou (KL) |
| Isotopes : | 36Cl | masse = 35,9683 um | radioactif : 301000 ans |
| 37Cl | masse = 36,9659 um | stable |
18 - L'ATOME d'Argon
Il compte dix-huit unités (q+) sur son NOYAU. C'est un gaz rare.
L'argon est un l'ATOME inerte car ses 18 ELECTRONS saturent deux par deux toutes ses orbites (M), de sorte qu'il n'a plus de disques de valence libres mais compte neuf disques de structure (K, L1, L2, L3, L4, M1, M2, M3 et M4).
Caracteristiques de l'Argon : ( 40Ar ) z = 18 masse = 39,948 um
| ÉLÉCTRON valence | = 0 |
| Disque sature | = (K + L + M) |
| Isotopes : | 36Ar | masse = 35,9675 um | stable |
| 38Ar | masse = 37,9627 um | stable | |
| 39Ar | masse = 38,9642 um | radioactif : 269 ans |
ATOMES complexes
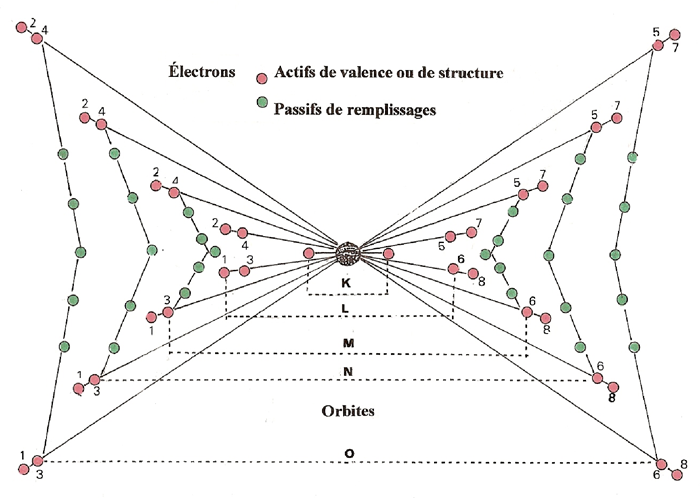
Dans un ATOME complexe, comme ceux qui suivent, on constate que les ÉLECTRONS se répartissent, sur les différents niveaux (K, L, M, N, O, et P) en deux catégories :
1 - Les ÉLECTRONS actifs (en rouge) exercent deux fonctions différentes :
- les uns, de valence ; ce sont ceux ( 4 au maximum par niveau) qui, seuls sur une orbite, génèrent un disque de valence.
- les autres, de structure ; ce sont ceux qui, deux par deux, saturent jusqu'à 4 orbites par niveau et génèrent un disque de structure.
ATTENTION un disque de structure compte 2 ÉLECTRONS
2 - Les ÉLECTRONS passifs (en vert) glissent entre les disques de structure des différents niveaux : jusqu'à (10), au niveau (Mp) ; jusqu'à (10 + 14), aux niveaux (Np et Op). Leur role se limite à compenser une quantité (q+) d'électricité.
19 - L'ATOME de Potassium
Il compte dix-neuf unités (q+) sur son NOYAU. C'est un métal alcalin.
Les dix-huit premiers ELECTRONS sont groupés comme sur le dessin de l'argon (z = 18 ) Lorsque le dix-neuvième se présente, attiré par la charge nucléaire résiduelle, il ne peut en subir l'attraction que sur l'une des orbites du niveau (N), par exemple l'orbite (n° 1). L'ATOME de potassium est univalent et possède neuf disques de structure.
Caracteristiques du Potassium : ( 39K ) z = 19 masse = 39,102 um
| ÉLÉCTRON valence | = 1(N) |
| Disque sature | = (K L M) |
| Isotopes : | 37K | masse = 36,9733 um | radioactif : 1226 s |
| 41K | masse = 40,9618 um | stable | |
| 42K | masse = 41,9624 um | radioactif : 12360 h |
20 - L'ATOME de Calcium
Il compte vingt unités (q+) sur son NOYAU. C'est un métal alcalino-terreux.
Les dix-neuf premiers ÉLECTRONS se placent comme dans le cas précédent, et le vingtième sur la première orbite du niveau (N).
Caracteristiques du Calcium : ( 40Ca ) z = 20
| ÉLÉCTRON valence | = 2(N) |
| Disque sature | = (K L M) |
| Isotopes : | 41Ca | masse = 40,9632 um | radioactif : 103000 ans |
| 42Ca | masse = 41,9586 um | stable | |
| 43Ca | masse = 42,9587 um | stable | |
| 44Ca | masse = 43,9555 um | stable | |
| 46Ca | masse = 45,9536 um | stable | |
| 48Ca | masse = 41,9624 um | radioactif : 6.1018 ans |
Les 10 types d'ATOMES qui suivent constituent une première série des métaux de transition
21 - L'ATOME de Scandium
Il compte vingt et une unités (q+) d'électricité sur son NOYAU.
Les vingt premiers ELECTRONS se calent comme dans le cas précédent, et le vingt et unième sur la troisième orbite du niveau (N).
Scracteristiques du Scandium : ( 45Sc ) z = 21 masse= 44,956 um
| ÉLÉCTRON valence | = 3(N) |
| Disque sature | = 9 KL |
| Isotopes : | 46Sc | masse = 45,955 um | radioactif : 43,79 j |
22 - L'ATOME de Titane
Il compte vingt-deux unités (q+) d'électricité sur son NOYAU.
Les vingt et un premiers ÉLECTRONS se calent comme dans le cas précédent et le vingt-deuxième sur la quatrième orbite (N).L'ATOME est quadrivalent, à moins qu'un ÉLECTRON ne tombe dans la zone passive du niveau (M) dans ce cas l'ATOME est trivalent.
Tiracteristiques du Titane : ( 48Ti ) z = 22 masse= 47,900 um
| ÉLÉCTRON valence | = 4(N) | ou 3(N) |
| Disque sature | = (K L M) | ou (K L M) |
| Electrons passifs (M) | = 0(M) | ou 1(M) |
| Isotopes : | 44Ti | masse = 43,9596 um | radioactif : 63 ans |
| 46Ti | masse = 45,9526 um | stable | |
| 47Ti | masse = 46,9517 um | stable | |
| 49Ti | masse = 48,9478 um | stable | |
| 50Ti | masse = 49,9458 um | stable |
23 - L'ATOME de Vanadium
Il compte vingt-trois unités (q+) d'électricité sur son NOYAU.
Les vingt-deux premiers ELECTRONS sont disposés comme ceux du Titane.(22). Lorsque le vingt-troisième se présente, il peut :
1 - saturer l'un des disques de valence du niveau (N), dans ce cas ;le Vanadium est trivalent et compte dix disques de structure ;
2 - se caler sur une orbite du niveau (O) et le Vanadium a 5 valences et compte neuf disques de structure ;
3 - glisser dans le vide du niveau (M); ou il devient un ELECTRON passif, dans ce cas le Vanadium est quadrivalent et compte neuf disques de structure et un ÉLECTRON passif du niveau (M)
Caracteristiques du Vanadium : ( 51V ) z = 23 masse= 50,9414 um
| ÉLÉCTRON valence | = 3(N) | ou 4(N) + 1(O) | ou 4(N) |
| Disque sature | = (KLM + 1N) | ou (KLM) | ou (KLM) |
| Electrons passifs (M) | = 0(M) | ou 0(M) | ou 1(M) |
| Isotopes : | 48V | masse = 47,9522 um | radioactif : 15,97 j |
| 49V | masse = 48,9485 um | radioactif : 330 j | |
| 50V | masse = 49,9471 um | radioactif : 1,5.1017 ans |
24 - L'ATOME de Chrome
iI compte vingt-quatre unités (q+) d'électricité sur son NOYAU.
Les six derniers ELECTRONS du Chrome peuvent tous rester indépendants, 4 au niveau (N) et 2 au niveau (O) et former six disques de valence. En revanche, il arrive que 3 ou 4 ELECTRONS passifs glisser dans l'espace vide du niveau (M).
Caracteristiques de Chrome : ( 52Cr ) z = 24 masse= 51,996 um
| ÉLÉCTRON valence | = 4(N)+2(O) | ou 3N | ou 2N |
| Disque sature | = (KLM) | ou (KLM) | ou 9KL |
| Electrons passifs (M) | = 0(M) | ou 3(M) | ou 4(M) |
| Isotopes : | 52Cr | masse = 51,946 um | radioactif : 1,8.1017 ans |
| 53Cr | masse = 52,9406 um | stable | |
| 54Cr | masse = 53,3938 um | stable |
25 - L'ATOME de Manganèse
Il compte vingt-quatre unités (q+) d'électricité sur son NOYAU.
Les 7 derniers ELECTRONS du Chrome peuvent tous rester indépendants : 4 au niveau (N) et 3 au niveau (O) et former 7 disques de valence. En revanche, certains (1,3,4ou 5) ELECTRONS passifs peuvent glisser dans l'espace vide du niveau (M).
Caracteristiques de Manganèse : ( 55Mn ) z = 25 masse= 54,9380 um
| ÉLÉCTRON valence | = 4(N) 3(O) | ou 4(N) 2(O) | ou 4(N) | ou 3(N) | ou 2(N) |
| Disque sature | = (KLM) | ou (KLM) | ou (KLM) | ou (KLM) | |
| Electrons passifs (M) | = 1(M) | ou 3(M) | ou 4(M) | ou 5(M) |
| Isotopes : | 48V | masse = 47,9522 um | radioactif : 15,97 j |
26 - L'ATOME de Fer
Il compte vingt-six unités (q+) d'électricité sur son NOYAU.
Parmi les huit derniers ELECTRONS de Fer deux passifs au moins tombent dans le vide du niveau (M), mais 3 ou 4 autres peuvent les rejoindre, de sorte que l'ATOME de Fer, selon les cas, présente 2,3 ou 6 ELECTRONS de valence
Caracteristiques de Fer : ( 56Fe ) z = 26 masse= 55,847 um
| ÉLÉCTRON valence | = 2(N) | ou 3(N) | ou 4(N) + 2 |
| Disque sature | = (KLM + 1N) | ou (KLM +1N) | ou (KLM) |
| Electrons passifs (M) | = 4(M) | ou 3(M) | ou 2(M) |
| Isotopes : | 54Fe | masse = 53,9406 um | stable |
| 55Fe | masse = 54,9382 um | radioactif : 2,73 ans | |
| 57Fe | masse = 56,9353 um | stable | |
| 58Fe | masse = 57,9332 um | stable | |
| 60Fe | masse = 59,9340 um | radioactif : 1,5.106 ans |
27 - L'ATOME de Cobalt
Il compte vingt-sept unités (q+) d'électricité sur son NOYAU.
Parmi les neuf derniers ELECTRONS de l'ATOME de Cobalt six au moins tombent dans le vide du niveau (M) mais un septième peut les rejoindre, de sorte que l'atome de Cobalt, selon les cas, présente 2 ou 3 "disques de valence", et plus ou moins de disques de structure et d'ÉLECTRONS passifs.
Caracteristiques de Cobalt : ( 59Co ) z = 27 masse= 58,9332 um
| ÉLÉCTRON valence | = 3(N) | ou 2(N) |
| Disque sature | = (KLM) | ou (KLM) |
| Electrons passifs (M) | = 6(M) | ou 7(M) |
Aucun Isotopes stable.
28 - L'ATOME de Nickel
Il compte vingt-huit unités (q+) d'électricité sur son NOYAU.
Parmi les dix derniers ELECTRONS de l'ATOME de Nickel, huit glissent inexorablement dans le vide du niveau (M)
Caracteristiques de Nickel : ( 58Ni ) z = 28 masse= 50,9414 um
| ÉLÉCTRON valence | = 2(N) |
| Disque sature | ou (KLM) |
| Electrons passifs (M) | 8(M) |
| Isotopes : | 59Ni | masse = 58,9343 um | radioactif : 76000 ans |
| 60Ni | masse = 59,9307 um | stable | |
| 61Ni | masse = 60,9310 um | stable | |
| 62Ni | masse = 61,9283 um | radioactif : 100 ans | |
| 64Ni | masse = 63,9279 um | stable |
29 - L'ATOME de Cuivre
Compte vingt-neuf unités (q+) d'électricité sur son NOYAU.
Parmi les onze derniers ELECTRONS de l'ATOME de Cuivre), neuf ou dix glissent dans l'espace vide du niveau (M) et il présente 1 ou 2 "disques de valence". et compte 9 disques de structure et 10 à 9 ELECTRONS passifs.
Caracteristiques de Cuivre : ( 63Cu ) z = 29 masse= 63,54 um
| ÉLÉCTRONS valence | = 2(M) | ou 1(M) |
| Disque sature | = (KLM) | ou (KLM) |
| Electrons passifs (M) | = 9(M) | ou 10(M) |
| Isotopes : | 65Cu | masse = 64,9277 um | stable |
30 - L'ATOME de Zinc
Il compte trente unités (q+) d'électricité sur son NOYAU.
Parmi les douze derniers ELECTRONS de l'ATOME de zinc, dix comblent définitivement le niveau (M) qui est saturé et 9 constituent des disques de structure Les deux ELECTRONS qui restent ne trouvent place que sur deux orbites ( N ). l'ATOME de zinc est bivalent
Caracteristiques de Zinc : ( 64Zn ) z = 30 masse= 65,37 um
| ÉLÉCTRON valence | = 2(N) |
| Disque sature | ou (KLM) |
| Electrons passifs (M) | = 10(M) |
| Isotopes : | 66Zn | masse = 65,9260 um | stable |
| 67Zn | masse = 66,9271 um | stable | |
| 68Zn | masse = 67,9248 um | stable |
Fin de la première série des ATOMES dits métaux de transition
31 - L'ATOME de Gallium
Il compte trente et une unités (q+) d'électricité sur son NOYAU. C'est un métal pauvre.
le trente et unième ELECTRON qui se présente ne trouve place que sur une troisième orbite (N). L'ATOME de gallium) est trivalent et possède 10 ELECTRONS passifs
Caracteristiques de Gallium : ( 69Ga ) z = 31 masse= 65,37 um
| ÉLÉCTRON valence | = 3(N) | ou 2(N) |
| Disque sature | = (KLM) | ou (KLM) |
| Electrons passifs (M) | = 10(M) | ou 10(M)+ 1N |
| Isotopes : | 71Ga | masse = 70,9247 um | stable |
32 - L'ATOME de Germanium
Il compte trente-deux unités (q+) d'électricité sur son NOYAU. C'est un métalloide. le trente-deuxième ELECTRON qui se présente ne trouve place que sur une quatrième orbite (Na).. L'ATOME de germanium est quadrivalent et possède (9) disques de structure.
Caracteristiques de Germanium : ( 74Ge ) z = 32 masse= 72,59 um
| ÉLÉCTRON valence | = 4(N) |
| Disque sature | = (KLM) |
| Electrons passifs (M) | = 10(M) |
| Isotopes : | 70Ge | masse = 69,9242 um | stable |
| 72Ge | masse = 71,9220 um | stable | |
| 73Ge | masse = 72,9234 um | stable |
33 à 35
Les quatre prochains ÉLECTRONS viendront se caler successivement, en opposition de phase avec le premier occupant sur l'une des orbites encore libres du niveau (N), il s'agit des 'ATOMES :
| d'arsenic | (75As - z = 33 et valence 3 ou 5), | Métalloide |
| de sélénium | (79Se - z = 34 et valence 2, 4 ou 6) | Non métal |
| de brome | (80Br - z = 35 et valence 1,3 ou 5) | Halogène |
36 - L'ATOME de Krypton
Il compte trente-six unités (q+) d'électricité sur son NOYAU. C'est un gaz rare.
Un trente-sixième, ÉLECTRON en se posant sur la dernière orbite (Na) encore libre, la sature.L'ATOME de krypton est inerte car sans disque de valence avec
Caracteristiques de Krypton : ( 84Kr ) z = 36 masse= 83,8 um
| ÉLÉCTRON valence | = 0 |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) |
| Isotopes : | 78Kr | masse = 79,9163 um | stable |
| 82Kr | masse = 81,9134 um | stable | |
| 83Kr | masse = 82,1413 um | stable | |
| 86Kr | masse = 85,9106 um | stable |
37 - L'ATOME de Rubidium
Il Compte trente-sept unités (q+) d'électricité sur son NOYAU. C'est un métal alcalin.
Le trente-septième ELECTRON ne peut trouver de place sur les couches (N) structuralement "saturées" et doit se caler sur une orbite "O" plus externe en dehors de l'angle "ϑ" qui contient les précédents ELECTRONS.
Caracteristiques de Rubidium : ( 85Rb ) z = 37 masse= 85,47 um
| ÉLÉCTRON valence | = 1(O) |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) |
| Aucun Isotope stable : |
38 - L'ATOME de Strontium
Il compte trente-huit unités (q+) d'électricité sur son NOYAU. C'est un métal alcalino-terreux.
Le trente-huitième ELECTRON se cale sur la deuxième orbite du niveau (O) et engendre un second disque
de valence
à l'extérieur de l'angle (ϑ). L'ATOME de strontium est bivalent et
compte 13 disques de structure et 10 ELECTRONS passifs au niveau (M).
Caracteristiques de Strontium : ( 88V ) z = 38 masse= 87,62 um
| ÉLÉCTRON valence | = 2(O) |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) |
| Isotopes : | 84Sr | masse = 83,91,34 um | stable |
| 86Sr | masse = 85,9117 um | stable | |
| 87Sr | masse = 86,9091 um | stable |
Deuxième suite des ATOMES de la série des métaux de transition
39 - L'ATOME d'Yttrium
Il compte trente-neuf unités (q+) d'électricité sur son NOYAU
Le trente-neuvième ELECTRON de l'atome d'Yttrium (z = 39) devient le troisième ÉLECTRON "actif" du niveau (O) et se cale sur un troisième "disque de valence" à l'extérieur de l'angle (ϑ). L'atome est trivalent.
Caracteristiques d'Yttrium : ( 89Y ) z = 39 masse= 88,9059 um
| ÉLÉCTRON valence | = 3(O) |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) |
| Aucun isotope : |
40 - L'ATOME de Zyrconium
Il compte quarante unités (q+) d'électricité sur son NOYAU
Le quarantième ÉLECTRON de l'atome de Zirconium (z = 40) devient le quatrième ÉLECTRON "actif" du niveau (O) et se cale sur un quatrième "disque de valence" à l'extérieur de l'angle (ϑ). L'atome est quadrivalent.
Caracteristiques de Zyrconium : ( 90Zr ) z = 40 masse= 91,22 um
| ÉLÉCTRON valence | = 4(O) |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) |
| Isotopes : | 91V | masse = 90,9056 um | stable |
| 92V | masse = 91,9050 um | stable | |
| 94V | masse = 93,9063 um | stable |
41 à 46
les ÉLECTRONS des ATOMES qui suivent, selon les influences extérieures, se calent au niveau (O) pour y jouer un role actif de valence ou de structure ou glissent dans la zone du niveau (N) pour compenser les charges nucléaires. Ces atomes ont des valences diverses entre 1 et 7. Il s'agit :
| NIOBIUM | 93Nb | z = 41 | valence : 3 ou 5, |
| MOLYBDÈNE | 96Mo | z = 42 | valences :2, 3, 4, 5, ou 6, |
| TECHNÉTIUM | 99Tc | z = 43 | valence 2, 4, 5, 6 ou 7, est radioactif sa période (demi-vie) est de 3,8 jours. Il se forme uniquement par désintégration du radium. |
| RUTHÉNIUM | 101Ru | z = 44 | valences3, 4, 6 ou 8 |
| RHODIUM | 103Rh | z = 45 | valences : 1 ou 3 |
| PALLADIUM | 106Pd | z = 46 | valences : 2 ou 4. |
47 - L'ATOME d'Argent
Il compte quarante-sept unités (q+) d'électricité sur son NOYAU.
Le niveau (N) est saturé avec: 8 ELECTRONS de structure et 10 "passifs" ; de ce fait, le quarante-septième ELECTRON ne peut se caler que sur une orbite du niveau (O) à l'extérieur de l'angle (ϑ) qui renferme tous les ELECTRONS précédents. L'atome d'Argent est univalent.
Caracteristiques d'Argent : ( 107Ag ) z = 47 masse= 107,87 um
| ÉLÉCTRON valence | = 1(O) |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) + 10(N) |
| Isotopes : | 109Ag | masse = 108,9047 um | stable |
48 - L'ATOME de Cadmium
Il compte quarante-huit unités (q+) d'électricité sur son NOYAU
Le 48ème ÉLECTRON se cale sur une deuxième orbite du niveau (O)
Caracteristiques de Cadmium : ( 114Cd ) z = 48 masse= 112,40 um
| ÉLÉCTRON valence | = 2 |
| Disque sature | = (KLMN) |
| Electrons passifs (M) | = 10(M) + 10(N) |
| Isotopes : | 106Cd | masse = 105,9064 um | stable |
| 108Cd | masse = 107,9041 um | stable | |
| 110Cd | masse = 109,9030 um | stable | |
| 111Cd | masse = 110,9041 um | stable | |
| 112Cd | masse = 111,9027 um | stable | |
| 116Cd | masse = 115,9047 um | stable |
Fin de la suite des ATOMES constituant la série des métaux de transition
49 - 53
| Indium | 115In | z = 49 | valences : 1,3 ou 4, | Métal pauvre |
| Etain | 119Sn | z = 50 | valences : 2 ou 4, | Métal |
| Antimoine | 122Sb | z = 51 | valences : 2, 3, 4, 5, 6 ou 7 | Métalloide |
| Tellure | 128Te | z = 52 | valences : 2, 4, ou 6 | Métalloide |
| Iode | 127I | z = 53 | valences : 1, 3, 5 ou73 | Hallogène |
54 - L'ATOME de Xenon
Il compte cinquante-quatre unités (q+) d'électricité sur son NOYAU. C'est un gaz rare.
Avec ses quatre disques saturés
au niveau (O)par huit ÉLECTRONS,le Xénon est un atome
inerte.
Caracteristiques de Xenon : ( 132V ) z = 54 masse= 131,3 um
| ÉLÉCTRON valence | = 0 |
| Disque sature | = (KLMNO) |
| Electrons passifs (M) | = 10 M + 10 N |
| Isotopes : | 126Xe | masse = 125,9042 um | stable |
| 128Xe | masse = 127,9038 um | stable | |
| 129Xe | masse = 128,9047 um | stable | |
| 130Xe | masse = 129,9035 um | stable | |
| 131Xe | masse = 130,9050 um | stable | |
| 134Xe | masse = 133,9043 um | stable | |
| 136Xe | masse = 135,9072 um | stable |
55 - L'ATOME de Cesium
Il compte cinquante-cinq unités (q+) d'électricité sur son NOYAU. C'est un métal alcalin.
Le cinquante-cinquième ELECTRON se cale sur une première orbite (P) à l'extérieur de l'angle (ϑ) qui renferme tous les ELECTRONS
Caracteristiques de Cesium : ( 133Cs ) z = 55 masse= 132,905 um
| ÉLÉCTRONS de valence | = 1P |
| Disque sature | = (KLMNO) |
| Electrons passifs (M) | = 10(M) + 10(N) |
| Isotopes : | 135Cs | masse = 134,9058 um | radioactif : 2,3.106 ans |
56 - L'ATOME de Barium
Il compte cinquante-six unités (q+) d'électricité sur son NOYAU. C'est un métal alcalino-terreux
Le cinquante-sixième ELECTRON se cale sur une seconde orbite (P) et constitue un deuxième "disque de valence". Cet atome est bivalent.
Caracteristiques de Barium : ( 138Ba ) z = 55 masse= 132,905 um
| ÉLÉCTRON valence | = 1P |
| Disque sature | = (KLMNO) |
| Electrons passifs | = 10(M) + 10(N) |
| Isotopes : | 130Ba | masse = 129,9062 um | stable |
| 132Ba | masse = 131,9050 um | stable | |
| 134Ba | masse = 133,9050 um | stable | |
| 135Ba | masse = 134,9056 um | stable | |
| 136Ba | masse = 135,9045 um | stable | |
| 137Ba | masse = 136,9058 um | stable | |
57 - L'ATOME de Lanthane
Il compte cinquante-sept unités (q+) d'électricité sur son NOYAU.
Le cinquante-septième ELECTRON se cale sur une troisième orbite (P) constituant un nouveau "disque de valence". Cet atome est trivalent.
Caracteristiques de Lanthane : ( 139La ) z = 57 masse= 138,91 um
| ÉLÉCTRON valence | = 3P |
| Disque sature | = (KLMNO) |
| Electrons passifs (M) | = 10(M) + 10(N) |
| Isotopes : | 138La | masse = 137,9071 um | radioactif : 1,05.1011 ans |
Les ATOMES qui suivent sont de la série des lanthanides qui ont des propriétés sembles au lanthane.
Cérium Ce ( z = 58), Praséodyme Pr (z = 59), Néodyme Nd (z = 60),
Prométhéum Pm (z = 61), est radioactif Il est très peu répandu. C'est un produit de la chaîne de désintégration de l'uranium.
Samarium Sm z = 62), Europium Eu (z = 63), Gadolinium Gd (z = 64), Terbium Td (z = 65), Dysprosium Dy (z = 66), Holmium Ho (z = 67), Erbium Er (z = 68), Thulium Tm (z = 69), Ytterbium Yb (z = 70) et Lutécium Lu (z = 71).
Troisième suite des Atomes de la série des métaux de transition
Les atomes suivants : constituent une suite d'atomes dont certains ELECTRONS passifs glissent dans l'espace vide au niveau (O), alors que d'autres actifs se placent sur des orbites du niveau (P)
Hafnium z = 72), Tantale (z = 73), tungstène (z = 74 Rhénium (z = 75), Osmium (z = 76), iridium (z = 77).
↑ Haut de page ↑78 - L'ATOME de Platine
L'ATOME de platine compte soixante-dix-huit unités (q+) d'électricité sur son NOYAU.
Les quatre derniers ELECTRONS se placent, comme premiers occupant, sur les quatre orbites du niveau (P), à moins que le quatrième se cale en opposition de phase sur l'une des orbites occupées et l'ATOME est bivalent
Caracteristiques de Platine : ( 195Pt ) z = 78 masse= 195,09 um
| ÉLÉCTRON valence | = 4P | ou 2P |
| Disque sature | = 17(KLMNO) | = 17(KLMNO + 1P) |
| Electrons passifs (M) | = 34MN + 6(O) | ou 34MN + 6(O) |
| Isotopes : | 190Pt | masse = 189,9599 um | radioactif : radioactif 650.109 ans |
| 192Pt | masse = 191,9610 um | stable | |
| 194Pt | masse = 191,9626 um | stable | |
| 196Pt | masse = 195,9649 um | stable | |
| 198Pt | masse = 197,9678 um | stable |
79 - L'ATOME d'Or
Il compte soixante-dix-neuf unités (q+) d'électricité sur son NOYAU.
Le soixante-dix-neuvième ÉLECTRON se cale avec un précédent sur une orbite (P) qui est saturée et l'atome des univalent ou glisse avec un autre du niveau (P) dans le vide de la zone (O).
Caracteristiques de l'Or : ( 197Au ) z = 79 masse= 196,967 um
| ÉLÉCTRON valence | = 3P | ou 1P |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) |
| Electrons passifs (M) | = 34MN + 8(O) | ou 34MN + 10(O) |
| Aucun isotope stable : |
80 - L'ATOME de Mercure
Il compte quatre-vingt unités (q+) d'électricité sur son NOYAU
Le quatre-vingtième ÉLECTRON glisse avec un du niveau (O) dans le vide correspondant et le sature. Il arrive qu'un ÉLECTRON glisse dans le dans le vide du niveau (P)
Caracteristiques de Mercure : ( 202Hg ) z = 80 masse= 200,59 um
| ÉLÉCTRON valence | = 2P | ou 1(P) |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) |
| Electrons passifs (M) | = 34 (MN) + 10(O) | ou (44MNO) + 1P |
| Isotopes : | 196Hg | masse = 195,9658 um | stable |
| 198Hg | masse = 197,9667 um | stable | |
| 199Hg | masse = 198,9682 um | stable | |
| 200Hg | masse = 199,9683 um | stable | |
| 201Hg | masse = 200,9707 um | stable | |
| 202Hg | masse = 201,9707 um | stable | |
| 204Hg | masse = 203,9734 um | stable |
Fin de la troisième suites d'ATOMES de la série des métaux transitoires.
81 - L'ATOME de Thallium
Il compte quatre-vingt-une unités (q+) d'électricité sur son NOYAU. C'est un métal pauvre.
Les trois derniers ELECTRONS se calent, comme premiers occupants, sur les trois orbites du niveau (P). Parfois l'un se calle sur lune orbite déjà occupée et la sature.
Caracteristiques de Thallium : ( 205Tl ) z = 81 masse= 204,3 um
| ÉLÉCTRON valence | = 3P | ou 1P |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) +1Q |
| Electrons passifs (M) | = (44MNO) | ou (44MNO) |
| Isotopes : | 203Tl | masse = 202,9723 um | stable |
82 - L'ATOME de Plomb
Il compte quatre-vingt-une unités (q+) d'électricité sur son NOYAU. C'est un métal.
Les derniers ELECTRON se calent individuellement sur 4éme orbites (P) ou avec un précédent sur l'une des orbites (P) qu'il sature.
Caracteristiques de Plomb : ( 208Pb ) z = 82 masse= 207,09 um
| ÉLÉCTRON valence | = 4P | ou 2P |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) +1P |
| Electrons passifs | = (44MNO) | ou (44MNO) |
| Isotopes : | 202Pb | masse = 201,9720 um | radioactif : 52500 ans j |
| 204Pb | masse = 203,9730 um | radioactif : 1,4.017 ans | |
| 205Pb | masse = 204,9744 um | radioactif : 1,53.017 ans | |
| 206Pb | masse = 205,9803 um | stable | |
| 207Pb | masse = 206,9759 um | stable |
83 - L'ATOME de Bismuth
Il compte quatre-vingt-trois unités (q+) d'électricité sur son NOYAU. C'est un métal pauvre.
Quatre ELECTRONS se calent sur les orbites (P) et un cinquième sur une orbite (Q) ou se couple avec un autre sur une même orbite (P) qu'il sature.
Caracteristiques de Bismuth : ( 209Bi ) z = 83 masse= 208,98 um
| ÉLÉCTRON valence | = 4P + 1Q | ou 3P |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) + 1P |
| Electrons passifs | = (44MNO) | ou (44MNO) |
| Isotopes : | 208Bi | masse = 207,9797 um | radioactif : 368000 ans |
84 - L'ATOME de Polonium
Il compte quatre-vingt-quatre unités (q+) d'électricité sur son NOYAU. C'est un métalloide.
Quatre ELECTRONS se calent sur les orbites (P) et deux sur des orbites (Q) à mois qu'ils forment un disque de structure (P) et éventuellement un second disque de structure (P)
Caracteristiques de Polonium : ( 210Po ) z = 84 masse= 210 um um Radioactif
| ÉLÉCTRON valence | = 4P +2Q | ou 4P | ou 2P |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) + 1P | ou 17(KLMNO) + 2P |
| Electrons passifs (M) | = (44MNO) | ou (44MNO) | ou (44MNO) |
85 - L'ATOME d'Astate
Il compte quatre-vingt-cinq unités (q+) d'électricité sur son NOYAU. C'est un halogène.
Les derniers ELECTRONS occupent les quatre orbites (P) et trois orbites (Q) à moins que par deux ils occupent un disque de structure (Q) puis de 1P à 3P.
Caracteristiques d'Astate : ( 210At ) z = 85 masse= 210 um Radioactif
| ÉLÉCTRON valence | = 4P +3Q | = 4P +Q | ou 3P | ou 1P |
| Disque sature | = 17(KLMNO) | ou 17(KLMNO) + 1Q | ou 17(KLMNO) + 1PQ | ou 17(KLMNO) + 3P |
| Electrons passifs (M) | = (44MNO) | ou (44MNO) | ou (44MNO) | ou (44MNO) |
86 - L'ATOME de Radon
Il compte quatre-vingt-six unités (q+) d'électricité sur son NOYAU. C'est un gaz rare.
Le quatre-vingtième ÉLECTRON ne peut se caler que sur une orbite libre du niveau (P) qu'il sature
Caracteristiques de Radon : ( 222Ra ) z = 86 masse= 222 um um Radioactif
| ÉLÉCTRON valence | = 0 |
| Disque sature | = 21(KLMNOP) |
| Electrons passifs (M) | = 44(MNO) |
87 - L'ATOME de Francium
Il compte quatre-vingt-sept unités (q+) d'électricité sur son NOYAU. C'est un métal alcalin.
le 87ème ELECTRONS se cale sur une première orbite (Q), ou il engendre un "disque de valence". Cet atome est univalent.
Caracteristiques de Francium : ( 223Fr ) z = 87 masse= 223 um um Radioactif
| ÉLÉCTRON valence | = 1Q |
| Disque sature | = 21(KLMNOP) |
| Electrons passifs | = 44(MNO) |
88 - L'ATOME de Radium
Caracteristiques de Radium : ( 226R ) z = 88 masse= 226,03 um um Radioactif
| ÉLÉCTRON valence | = 2Q |
| Disque sature | = 21(KLNOP) |
| Electrons passifs (M) | = 44(MNO) |
89 - 92
Les ATOMES qui suivent sont radioactifs et constituent la série des actinides
Dans l'atome d'actinium, (z = 89) le dernier ELECTRONS se cale sur une troisième orbite (Q) ou il engendre un troisième "disque de valence". L'actinium a une période radioactive de (14.109) années. On le trouve dans la chaîne de désintégration de l'uranium
Dans l'atome de THORIUM, (z = 90) le dernier ÉLECTRON se cale sur une quatrième orbite (Q) ou il engendre un quatrième "disque de valence", à moins qu'il glisse dans l'espace vide de la couche (P). Dans ce cas, l'atome est trivalent. Sa période radioactive est de 37.760 ans
Le protactinium (z = 91), est Polyvalent, certains de ses ELECTRONS restent au niveau (Q) alors que d'autres glissent pour combler l'espace vide du niveau (P). Il a 3, 4 ou 5 disques de valence et sa période radioactive est de 34.000 ans.
L'uranium (z = 92) est polyvalent certains de ses ELECTRONS restent au niveaux (Q et L) ou tombent dans l'espace (P). Selon les cas il a 2, 3, 4, 5 ou 6 disques de valence, sa période radioactive est de (4,46.109 ans)
93 - 118
Tous les ATOMES qui suivent sont TRANSURANIENS. Du fait de leur radioactivité ils n'existent pas sur Terre à l'état naturel.
Le neptunium (z = 93) est le premier d'entre eux. Sa période radioactive est de (2,14.106 années). On en trouve des traces dans le minerai de l'uranium.Le plutonium (z = 94) a une période radioactive de (80.106 ans), on en trouve quelques traces sur Terre.
L'américium (z = 95) a une période radioactive, de (7.370 années) il n'est pas présent sur Terre.
AINSI DE SUITE jusqu'à l'ununbium (z = 112) dont la durée de vie n'excède pas quelques microsecondes.

