EAU :
L'eau, l'élément le plus abondant sur terre, mérite qu'on s'y attarde, car elle est indispensable à la vie.
Dans la molécule d'eau :- L'Hydrogène, univalent, ne peut se lier à un autre atome que par son seul disque de valence.- L'Oxygène, bivalent, peut, en revanche, se lier à deux atomes d'Hydrogène selon la Figure ci-dessous.

Lorsque les conditions de température sont favorables (300 °K) et qu'un atome d'Oxygène heurte successivement deux atomes d'Hydrogène avec une énergie suffisante, cet atome d'Oxygène peut se combiner, par liaisons covalentes, avec deux atomes d'Hydrogène pour former une molécule d'eau.
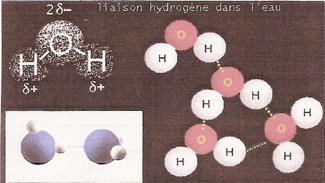
A - Le dessin de gauche ci-dessus est proche de la réalité ; Les molécules d'eau, du fait du phénomène d'ionicité, se présentent comme un triangle isocèle au sommet duquel se trouve l'atome d'Oxygène, légèrement négatif, tandis que les deux atomes d'Hydrogène, légèrement positifs, occupent les deux autres cotés.
B - La représentation de droite, ci-dessus, est une représentation symbolique souvent utilisée.
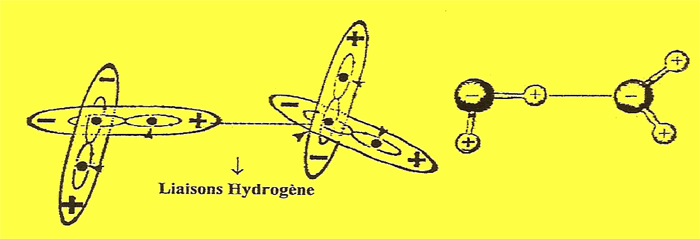
Cette entité, appelée "eau", est libre de se mouvoir en tous sens. Elle est, entre autres, capable, par une liaisons Hydrogène, de se lier à d'autres molécules identiques dans des structures cristallines (Figure ci dessus).
Entre deux molécules d'eau, la pont hydrogène est directionnelle: elle s'aligne dans l'axe de la liaison de valence qui lui est associée. Par exemple, dans l'eau, les 3 atomes O, H et O de la liaison O-H..O sont alignés. Cette propriété permet d'avoir des architectures moléculaires très bien définies, comme dans la glace ou dans l'eau à courte distance, ou encore dans les molécules biologiques telles que les protéines, ou l'ADN dont les deux brins sont liés entre eux par liaisons hydrogène.
 |
L'énergie de formation de la pont hydrogène est de l'ordre des énergies mises en jeu dans les fluctuations thermiques à la température ambiante 27° Celsius. Aussi, de telles liaisons peuvent-elles se tordre, se rompre ou se restaurer à cette température. Cette propriété donne aux architectures moléculaires assemblées par liaisons hydrogène, souplesse et possibilité d'évoluer à la température ambiante, ce que ne peuvent faire les liaisons de valence, beaucoup trop énergétiques et donc complètement rigides à cette même température. |
Or, cette souplesse et ces possibilités d'évolution sont indispensables aux molécules biologiques.
En dessous de 0 C, l'agitation thermique diminuant, sous l'action des forces électrostatiques les dimères tendent à s'organiser en un réseau solide à trois dimensions.
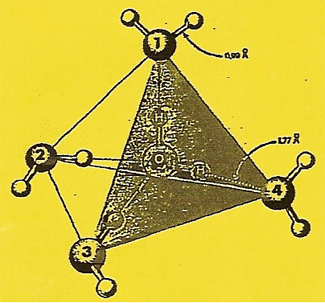 |
Lors de la formation de la glace : autour d'une molécule d'eau, quatre autres occupent individuellement l'un des sommets d'un tétraèdre. Ceci, conformément à la Figure ci-contre ou l'on constate que la distance entre le centre du noyau de l'atome d'Hydrogène de la molécule marquée zéro et le centre du noyau d'Oxygène de la molécule marquée 4 est égale à 1,77 Å. Cette dimension est celle des liaisons hydrogène :x = 1,77 Å < (1,2 + 0,75 = 1,95 Å). |
Dans le milieu non contraignant de l'atmosphère, la symétrie des cristaux élémentaires explique la structure légère et harmonieuse des flocons de neige.
Il est évident que, en dessous de 0°C, la glace contient de la chaleur. les molécules d'eau vibrent autour de leur position d'équilibre. Si la température ambiante augmente, les molécules périphériques vibrent avec une amplitude croissante. Ces vibrations se communiquent de proche en proche. Certaines molécules se détachent de leurs voisines. Nous appelons cela la fusion. Si nous diminuons la température, les vibrations diminuent jusqu'à s'arrêter lorsque la température atteint le zéro absolu.
Propriétés chimiques
Les molécules d'eau (H2O) ont une telle attirance (liaison hydrogène) les unes pour les autres qu'il arrive qu'un atome d'hydrogène de l'un soit capté par l'atome d'oxygène de l'autre.
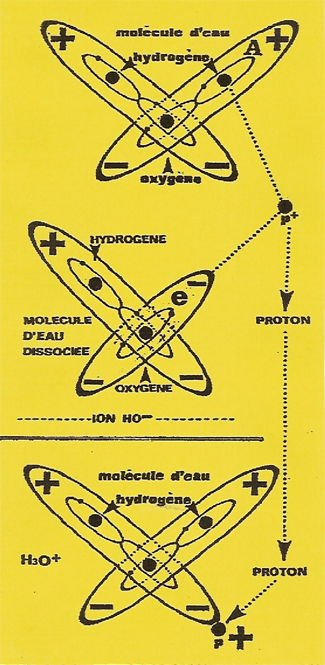 |
⇐ Sur la Figure ci-contre, lorsque la molécule d'eau (A) subit une poussée violente sur l'un de ses atomes d'Hydrogène le NOYAU ou (PROTON P+) est expulsé et s'éloigne, libre de toute contrainte, ⇐ Alors que l'ÉLECTRON est retenu sur l'orbite de l'Oxygène en opposition de phase avec le premier. Cette dissociation s'écrit ⇐ H2.O → HO- + P+ (HO-) représente la molécule privée d'un PROTON. Ce dernier généralement ne reste pas longtemps libre : Ce PROTON soit se recombine à l'ion (H.O-) pour reformer une molécule d'eau (H2.O) comme sur la figure d'en haut. ⇐ soit qu'il s'assemble à une molécule d'eau (H2O) pour former un ion Hydronium (H2.O P+ = H3 .O+) Figure ci-contre. |
ACIDITÉ ou BASICITÉ de L'EAU
A 22 °C, dans un kilogramme d'eau pure, on compte 10-7 grammes d'ions (O-) et autant d'ions Hydronium (H3.0+). La concentration (Ki) de l'eau en ions Hydronium est exprimée par la relation :
pH = -log Ki ; à 22°C, on a Ki = 10-7 et pH = 7
pH = potentiel Hydrogène = 7 définit la neutralité de l'eau.
Réaction avec un acide : Dans l'eau, un acide (H A) tend à libérer son atome d'Hydrogène mais souvent le choc violent arrache seulement le Proton.
(H2O) + (H A) → A- + P+ + H2O → A- + H3O+
Attention: (2H) est le symbole du deutérium et (H2) signifie qu'il y a 2 atomes d'hydrogène dans la molécule.
Le PROTON ne reste pas longtemps libre et se colle à une molécule d'eau (Figure ci-dessus) pour former un ion (H3O+). La concentration de la solution en ions (H3O+).augmente. Si, par exemple, elle atteint la valeur Ki = 10-5 ions gramme par litre
pH = - log Ki = 5 ; pH = 5 < 7 → solution acide
Réaction avec une base : Inversement, une base (B OH) libère un ion (HO-) dont l'atome d'Oxygène est accompagné d'un électron supplémentaire arraché à la molécule (B) (B+ + HO-)
L'ion (HO-) se combine au proton d'un ion Hydronium (H3O-) pour reconstituer deux molécules d'eau
(HO-) + (H3O+) = 2(H2O)
La concentration en Hydronium (H3O+) diminue. Si, par exemple, elle atteint la valeur 10-8 ions gramme par litre,
pH = - log 10-8 = 8 ; pH = 8 > 7 ⇒ solution basique
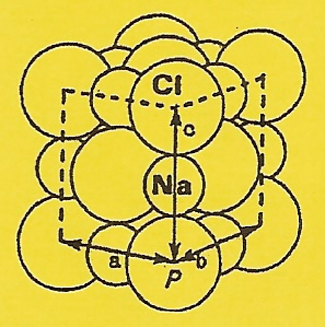 |
Réaction avec des cristaux de sel : Si, maintenant, nous
mettons des cristaux de Chlorure de Sodium dans de l'eau, les extrémités négatives
des molécules d'eau attirent certains |
Si l'on met peu de sel dans l'eau, davantage d'ions se dissocient et le sel se dissout.
Au contraire, si l'eau contient beaucoup de sel dissout, davantage d'ions se soudent et le sel se cristallise.
Si on augmente la température de la solution, le nombre d'ions qui s'échappent augmente et le sel se dissout plus facilement.
L'organisation des atomes au sein de la matière se réalisa selon diverses structures.

