Différents liens entre atomes
Généralités
L'ĂLECTRON ne se mĂȘle pas au PROTON parce qu'il est entourĂ© d'une atmosphĂšre qui dĂ©finit une zone d'impĂ©nĂ©trabilitĂ©.
Ainsi protĂ©gĂ©, l'ĂLECTRON ne heurte pas directement la lourde masse du PROTON mais roule Ă sa surface et s'enroule autour alors que son bouclier dĂ©crit un disque de valence.
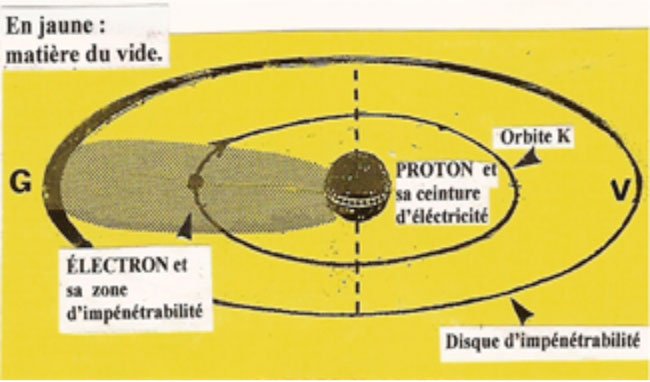
Lorsqu'un ĂLECTRON, Ă la vitesse de (2200 km/s), tourne autour d'un PROTON devenu le NOYAU d'un ATOME d'HYDROGĂNE, sa zone d'impĂ©nĂ©trabilitĂ© s'aplatit.
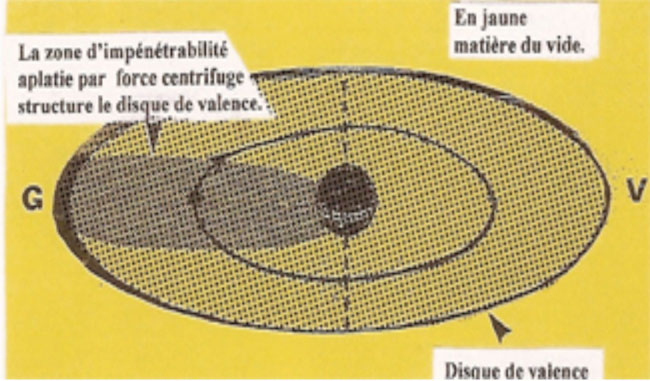
La zone d'impénétrabilité aplatie par la force centrifuge structure un disque de valence dont le rayon (Rv) donne la mesure extérieure de l'atome.
L'ATOME de béryllium
Il possède quatre électrons qui tournent autour d’un noyau enveloppé de quatre unités d’électricité positive (q+).
Les 2 premiers ELECTRONS se placent en opposition de phase sur l'orbite (K).
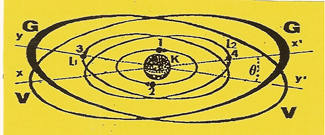
Le troisième étant sur l'orbite (L1) passant par le plan (yy'), lorsque le quatrième se présente, attiré par la charge résiduelle (q+) de la ceinture nucléaire, il ne peut en subir l'effet attractif que sur l'axe (xx'). Il s'y place de façon que sa zone d'impénétrabilité roule sur l'orbite (K) et que lui-même décrive l'orbite (L2) diamétralement à l'opposé du troisième ELECTRONS.
Les quatre ELECTRONS s'équilibrent électriquement entre eux et avec le noyau, comme indiqué sur la Figure. Les deux premiers électrons saturent l’orbite (K) Les deux autres restent sur leur orbite (L1 et L2). Chacune se prolonge par un disque de valence.
L’atome de Béryllium est bivalent et possède un disque de structure (K).
Dans les atomes plus complexes les électrons ont tendances à se grouper par deux sur une même orbite qu’ils saturent. De ce fait ces électrons ne donnent pas lieu à un disque de valence. Dans les atomes plus complexes, les quatre électrons externes peuvent rester libres sur leur orbite et développer chacun un disque de valence.
Pour plus de détails voir disque de valence dans le dictionnaire
Liens de Van der Waals entre atomes
De par leur structure les atomes ont la faculté de se lier
Dans les planètes, les atomes s´assemblèrent pour former des cristaux par liaisons de Van der Waals
Liens entre atomes univalents :
La plus élémentaire des liaisons est celle qui unit deux atomes d´HYDROGENE. Nous les prendrons comme exemple.
Les ATOMES libres sont des objets électriquement neutres : les charges inverses du NOYAU et de l´ELECTRON se neutralisent.
En plus des coordonnées spatiales d´un ATOME d´HYDROGENE et sa vitesse (énergie cinétique), il est important de connaître le sens de rotation de son ELECTRON, ce qu´on appelle son vecteur de phase.
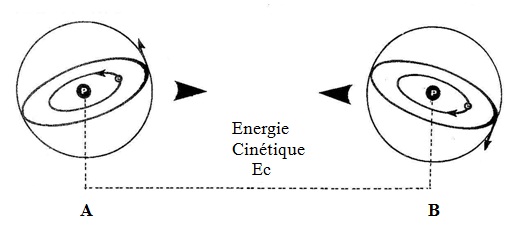
Les ELECTRONS de deux atomes d´HYDROGENE (A) et (B) tournent à la mê;me vitesse, mais pas forcément dans le même sens. Ils entraînent avec eux leurs disques de valence.
Arbitrairement, on attribue au disque de valence de l´atome (B), dont l´ELECTRON tourne dans le sens des aiguilles d´une montre, un vecteur de phase orienté vers le bas ; au disque de valence de l´atome (A), dont l´ELECTRON tourne en sens inverse, un vecteur de phase orienté vers le haut.
Tout aussi arbitrairement, on attribue à l´atome (A) le symbole H↑ et à l´atome (B) le symbole H↓. Ce qui permet d´écrire que deux atomes H↑ et H↑ orientés dans le mê;me sens, sont parallèles et que deux atomes H↑ et H↓ orientés en sens inverse sont antiparallèles.
De toute façon, il ne s´agit pas de deux structures différentes, mais de disques de valence dont l´électron gravite en sens inverse par rapport à l´autre. Il suffit que l´atome (A) pirouette sur lui-mê;me pour correspondre à l´atome (B).
Les ATOMES (A) et (B), ayant une énergie cinétique (Ec), due à l´agitation thermique de leur environnement, ne tardent pas à se heurter par leurs disques de valence.
Il faut se souvenir qu´un électron est entouré d´une zone d´impénétrabilité qui, lorsqu´un électron tourne autour de son noyau, y décrit un disque de valence.
1 - Si leurs vecteurs de phase sont parallèles, lors du choc, les deux disques de valence tournant dans le mê;me sens, rebondissent l´un sur l´autre et repartent en sens inverse.
2 - Si leurs vecteurs de phase sont anti-parallèles, lors du choc, leurs deux disques de valence tournent en harmonie et se pénètrent plus ou moins en fonction de leur énergie cinétique globale (Ec).
a) Ec < 0,02 eV : les deux disques de valence des atomes (A) et (B) électriquement neutre rebondissent l´un sur l´autre sans se pénétrer
b) Ec = 0,02 eV : les deux disques de valence se croisent légèrement en mê;lant leur énergie gravitationnelle, ce qui crée entre eux une force (Fa) dite d´ancrage ou de Van der Waals qui les lie avec une énergie (Wa = 0,02 eV).
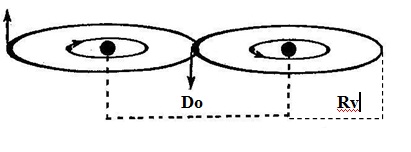
Dans cette position (Figure n° 81), leurs NOYAUX sont séparés d´une distance (Do ~ 2 Rv = 1,2 Å). Leurs deux disques de valence s´alignent dans le mê;me plan et les ELECTRONS se calent en phase sur leur orbite, de façon à y occuper une position identique par rapport aux NOYAUX.
c) Ec > 0,02 eV < 4,45 eV : plus l´énergie (Ec) est importante :
- plus les deux disques de valence se pénètrent : (x = Do - Δx)
- plus puissants sont les ondes de choc qui, dans l´énergie des disques de valence, se propagent vers les NOYAUX et les déstabilisent par rapport à l´orbite de leur ELECTRON, de sorte que ce dernier laisse percevoir à travers chaque orbite une fraction (dq+) de plus en plus grande de la charge électrique de chaque NOYAU. Ces fragments (dq+) de charge qui se font face créent entre elles une force répulsive (Fr) qui repousse les NOYAUX : les deux ATOMES oscillent entre les distances (Do ± Δx) (Figure n° 82) et finissent par s´immobiliser en (Do), comme sur la Figure n° 81. Les NOYAUX et les ELECTRONS ayant retrouvé leur équilibre, la force répulsive (Fr) disparaît et les deux ATOMES se stabilisent dans les positions de la Figure n° 81, liés par la force (Fa) d´ancrage ou de Van der Waals.
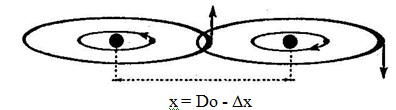
Les électrons sont entourés d´une zone d´impénétrabilité qui, lorsqu´un électron tourne autour d´un noyau, devient un disque de valence. La charge électrique d´un noyau est neutralisée par celle de l´électron, de sorte que deux atomes, dans état stable, ne s´attirent pas. .
Liens entre atomes bivalents
Nous étudierons ce cas sans préciser l´élément chimique dont il est question, sachant que tout ce que nous écrirons à propos d´un ATOME bivalent vaudra pour tous les ATOMES complexes.
Selon la façon dont s´abordent deux ATOMES libres, ils se lieront selon les Figures n° 83 ou 84, avec une force d´ancrage ou de Van der Waals, propre à chacun de leurs disques de valence.
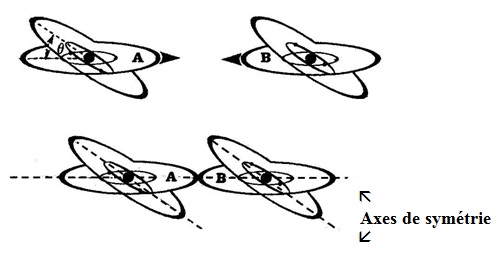
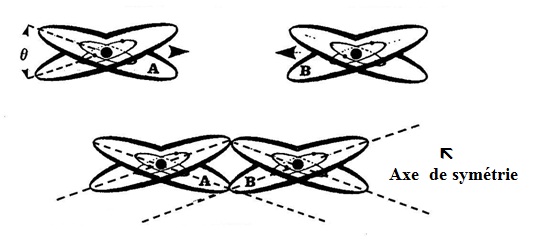
- Lorsque plusieurs combinaisons sont possibles, seul le hasard détermine le choix initial, mais dès qu´une première liaison s´est constituée les autres se forment selon les mêmes axes de symétrie.
- La distance (Do) qui sépare deux NOYAUX voisins est très légèrement inférieure au double du rayon (Rv) d´un disque de valence (Do ≈ 2 . Rv).
- Selon l´ampleur des forces d´ancrage (Fa) et des axes de symétrie des cristaux élémentaires, les solides qui en sont constitués se présentent différemment. Généralement, les lignes de structures sont peu exprimées et la matière est sous la forme d´un agrégat de cristaux élémentaires orientés au hasard. Certains ont, cependant, des forces de symétrie très prononcées, ce qui leur donne une structure généralement ordonnée selon un ou plusieurs axes.

