Liens covalents entre atomes
Dans les planètes, les étoiles, les galaxies les atomes s´assemblèrent des atomes pour former des molécules par liens covalents
Entre atomes univalents
Nous prendrons comme premier exemple deux ATOMES d´HYDROGENE.
Si l´énergie cinétique (Ec) qui anime deux ATOMES antiparallèles est largement supérieure à celle qui créa des liaisons cristallines (page 83), leurs disques de valence se pénètrent largement jusqu´à croiser leurs orbites électroniques et même au-delà.
Quelle que soit l´énergie (Ec) qui anime les ATOMES, au moment du heurt, il se crée, dans chaque disque de valence à partir du point d´impact, une onde de choc vers le NOYAU correspondant. Chaque onde de choc, en rencontrant le NOYAU, le déstabilise par rapport à son orbite électronique, de sorte qu´il laisse apparaître une fraction (dq+) de sa charge électrique. Ces deux fractions (dq+) qui se font face créent entre les NOYAUX une force de répulsion (Fr) proportionnelle à (Ec).
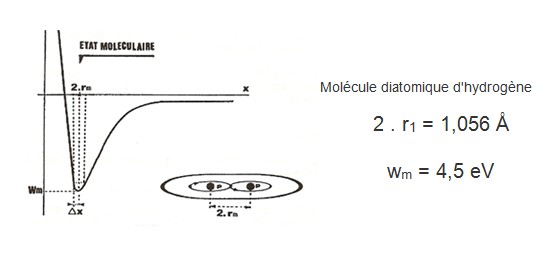
a) Si (Ec) est légèrement supérieur à (4,5 eV), les ATOMES d´HYDROGENE se pénètrent jusqu´à ce que leurs orbites électroniques se touchent (Figure n° 90), de sorte que les NOYAUX sont séparés d´une distance (Dm = 2 . r1). En mêlant leur énergie gravitationnelle, il se crée, dans leurs disques de valence, une force (Fm) dite moléculaire, qui les lie avec une énergie (Wm = 4,5 eV).
Par ailleurs, les NOYAUX déstabilisés par l´onde de choc laissent percevoir chacun une fraction (dq+) de leur charge. Ces deux fractions (dq+) face à face génèrent une force répulsive (Fr) qui repousse les deux NOYAUX.
Progressivement, l´onde de choc se dispersant, la force (Fr) répulsive s´estompe, les NOYAUX reprennent leur position par rapport aux orbites électroniques. Les deux ATOMES se retrouvent dans la position de la Figure n° 90, liés par la force moléculaire (Fm).
b) Si (Ec) est nettement supérieur à (4,5 eV), l´onde de choc ouvre entre les NOYAUX une fenêtre plus large à travers laquelle se crée une force répulsive électrique qui repousse énergiquement les deux ATOMES loin l´un de l´autre.
Remarque :
Les énergies (Wa et Wm) qui correspondent aux forces d´ancrage de Van Der Walls (Fa) et aux forces (Fm) moléculaires ou de covalence (Fm), sont également celles qui correspondent à l´énergie nécessaire pour séparer deux ATOMES précédemment liés dans les mêmes conditions.
L´oscillation de deux ATOMES de part et d´autre du point d´équilibre (Dm) (Figure n° 90) rappelle celle d´un ressort qui, écarté de son point d´équilibre, met un certain temps à se stabiliser. De même, si un choc écarte peu deux ATOMES d´une molécule de leur point d´équilibre, ils oscilleront autour de ce point avant de se stabiliser. Si le choc est trop fort, les deux atomes se séparent.
Gaz diatomique d´HYDROGENE
L´HYDROGENE se présente, dans la nature, sous forme d´une molécule diatomique (Figure n° 90).
La distance moyenne entre les NOYAUX est de (Dm = 2 . r1 = 1,056 Å) et il faut 102,5 Kcal par mole (soit 4,45 eV) pour séparer les deux atomes.
Cette molécule est très stable et ne se dissocie qu´à très haute température. Sous une pression d´une atmosphère, on observe que :
- à 2.000°K : 7.10-6 pour 100 de molécules sont dissociées
- à 3.000°K : 7,9 pour 100 de molécules sont dissociées
- à 4.000°K : 62 pour 100 de molécules sont dissociées
- vers 6.000°K : la dissociation des molécules est complète ; le gaz est monoatomique.
Cette stabilité des molécules diatomiques d´HYDROGENE, jusqu´à 2.000°K et au-delà, tient compte d´une moyenne car, lorsqu´une molécule se dissocie, une autre se crée. En effet, il faut la même énergie pour lier des atomes que pour les dissocier.
Entre atomes bivalents :
Selon leur orientation originale, deux ATOMES bivalents, s´ils ont une énergie cinétique (Ec) suffisante, peuvent se lier par une force moléculaire dite aussi covalente, selon les Figures n° 91 ou 92.

Exemple de l´OXYGENE :
Dans la basse atmosphère, on trouve généralement l´OXYGENE à l´état diatomique, selon la structure de la Figure n° 92. La distance entre les deux NOYAUX est de (1,21 Å). Les physiciens, au lieu de la Figure n° 92, se contentent d´une représentation plus simplifiée (Figure n° 93).
Dans la haute atmosphère (25 km), à la densité extrêmement faible (2,10-8), sous l´influence des ultraviolets solaires et d´effluves électriques, trois atomes d´OXYGENE s´assemblent en une molécule appelée OZONE (Figure n° 94).
Entre atomes trivalents
Trois disques de valence d´un atome peuvent engendrer, vis-à-vis de plusieurs atomes, trois ondes de liaison et constituer entre eux soit des cristaux, soit des molécules. Quatre disques de valence d´un atome peuvent engendrer vis-à-vis de plusieurs atomes, quatre liaisons et constituer entre eux des molécules complexes.
Exemples :
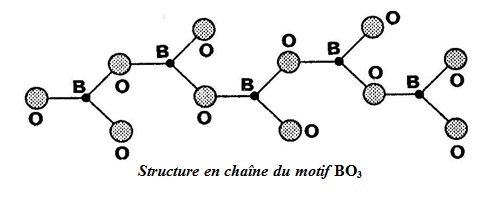
1 - Le BORE trivalent et l´OXYGENE bivalent forment des chaînes BO3 selon la Figure 95.
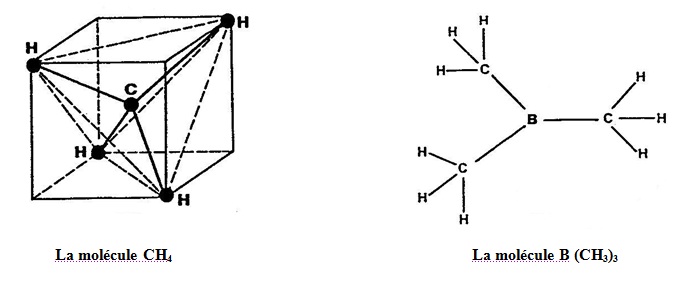
2 - Un CARBONE quadrivalent peut se lier à quatre HYDROGENES univalents (Figure 96).
3 - Le BORE peut se lier à 3 CARBONES quadrivalents, lesquels se lient chacun à 3 HYDROGENES en une molécule [B (CH3)3] .
Entre Carbone quadrivalent
Ses disques de valence de rayon (Ri = 0,8 Ã…) peuvent se lier avec ceux de plusieurs atomes de Carbone, pour créer des structures cristallines.
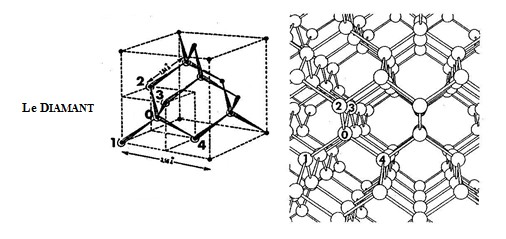
A - Le Diamant (Figure n°85) : La structure cubique du diamant est telle que chacun des quatre disques de valence d'un atome numéroté 0 se lie avec l'un des disques de valence de quatre autres atomes (1, 2, 3 et 4).
La distance Do entre les noyaux de deux atomes liés est :
Do = 1,54 Ã…< 2 . Ri = 1,60
De par sa structure, le diamant est le plus dur de tous les matériaux ; il est un isolant électrique mais un bon conducteur thermique.
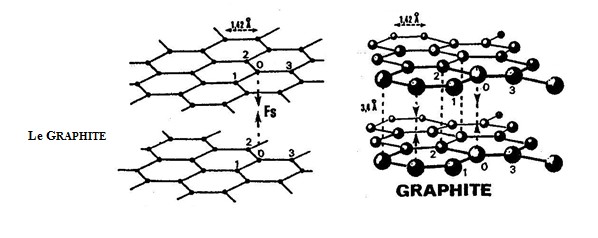
B - Le Graphite (Figure n°86) : Trois des quatre disques de valence d'un atome de Carbone (0) ont chacun une liaison de "Van der Waals" avec l'un des disques de valence de trois atomes voisins (1, 2 et 3).
Le quatrième disque des atomes "0" correspond à une liaison de structure de force (Fs) perpendiculaire aux plans. Ici, deux couches sont représentées ; généralement, il y en a de multiples, toutes liées par des liaisons de structure secondaires de force (Fs).
La distance (Do) entre les noyaux de deux atomes liés est
Do = 1,42 Ã < 2 . Ri = 1,60
La distance (Do) entre deux couches est d´environ (3,4 Ã).Elle est assez réduite pour assurer entre les quatrièmes disques de valence des atomes de Carbone superposés une "force de nature gravitationnelle", dite de structure (Fs). Les couches ainsi faiblement reliées entre elles sont susceptibles de glisser les unes sur les autres. Quand on touche un morceau de graphite, on a l´impression curieuse de tenir un savon glissant.On tient, en effet, la couche externe mais celle-ci glisse sur le reste du solide.
Le graphite sous forme de fines paillettes constitue un excellent lubrifiant.
Les électrons des disques de valence qui assurent une faible liaison entre deux couches sont relativement libres de s´échapper de sorte que le graphite est un bon conducteur d'électricité et de la chaleur.
Fibres de Carbone : Le Carbone est un solide dont la résistance à la traction est supérieure à celle de l´acier.L´industrie fabrique, aujourd'hui, des fibres de carbone tissées de telle sorte qu´il y ait toujours des fibres orientées dans la direction de l´effort sollicité. Généralement, cet ensemble de fibres est noyé dans une résine qui donne à la pièce la forme désirée.
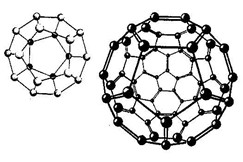
En i985, les physiciens fabriquent des structures de 20 Ã 60 atomes de Carbone liés par des forces de Van Der Waals, en forme de ballon. Certains de celles-ci peuvent dépasser les 70, 80... atomes.
Cristaux divers :
Nous avons étudié les cristaux élémentaires formés d'une même espèce atomique, le Carbone. Mais des atomes différents ou des molécules peuvent s´assembler dans la structure d´un cristal élémentaire.
Si les forces d´ancrage "Fa" et les axes de symétrie d´un cristal élémentaire s´étendent dans les trois dimensions (Diamant), ce cristal s´assemble avec ses voisins dans un volume rigide souvent très dur. Si, au contraire, les forces d´ancrage "Fa" et les axes de symétrie d´un cristal élémentaire s´étalent dans un seul plan, ce cristal s´assemble avec ses voisins pour former des feuillets (graphite), lesquels sont plus ou moins tenus à distance par des ponts avec une "forces de structure" Fs. Dans certains cas, comme le mica (silicate d'aluminium et de potassium), les feuillets forment de larges couches superposées, facilement clivables entre elles.
Si la force d´ancrage "Fa" qui structure les feuillets est faible, ceux-ci sont minuscules et forment une matière à la consistance onctueuse au toucher, comme le talc (silicate de magnésium).
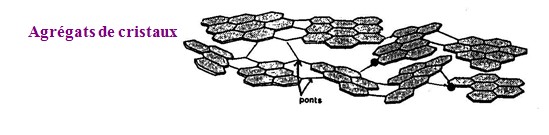
Certains solides sont constitués d'un agrégat de cristaux minuscules (électriquement neutres) liés par des "ponts" entre deux disques de valence, chacun appartenant à un cristal minuscule différent. Ces "ponts" correspondent à des "forces de structure" Fs qui agissent à distance (2,5 à 4 Ã).
Cette "force de structure " (Fs) est faible (1/10 Kcal/mole) mais un grand nombre de "ponts" donne au solide une grande rigidité. La Figure nº88 schématise un agrégat théorique.
Le verre
Dans le verre, le passage de l´état liquide à l´état solide se fait progressivement par augmentation de la viscosité. La substance devient pàteuse et se solidifie sans organisation apparente.Si, à l´échelle macroscopique, le verre se présente sans structure, c´est qu´il est constitué de cristaux élémentaires qui se collent en tous sens par leurs seules forces de structure (Fs). Chaque cristal élémentaire est constitué d´une molécule de Silicium quadrivalent lié à quatre atomes d´Oxygène, chacun lié à deux atomes de Silicium. L´ensemble est un solide désordonné, dont les "cristaux élémentaires" sont serrés les uns contre les autres.
Les gels
Les gels réversibles se forment parce que des atomes ou des molécules liés par des forces d´ancrage "Fa" de Van Der Waalsforment des chaînes flexibles entre lesquelles s'établissent des "ponts de structures externes Fs". Un grand nombre de "ponts" constitue un réseau tridimentionnel formant un amas géant, le GEL, dont la taille est celle du récipient.
Divers matériaux tels les yaourts, les caoutchoucs, les confitures,... ont en commun leur mécanisme de formation par gélification. Celle-ci s'accompagne de modifications réversibles des propriétés mécaniques des matériaux : semi liquides, plastiques (malléables), semi solides,...
L'adhérence des gels sur les surfaces solides est liée à leur élasticité : plus le gel se déforme facilement, plus il adhére. En effet, comme le gel est mou, sa surface épouse celle de la paroi avec laquelle il est en contact. Les forces d´ancrage de Van der Waals s´exercent sur toute l´interface et assure l´accrochage.
Les cristaux métalliques
Un solide métallique est un agrégat de cristaux minuscules collés par des "ponts" de structure (Fs).A travers ce réseau circulent en tous sens des électrons libres sautant d'atome en atome.
Dans un câble sous tension, les électrons sont orientés tous dans le même sens, celui du courant électrique. Selon l´énergie et le nombre des "ponts de structure", les métaux sont plus ou moins malléables.
Liens électriques
Cristaux ioniques
Il faut différencier deux familles d´atomes (Voir Tome 1) :
- les éléments ALCALINS (A) et ALCALINO-TERREUX (AT) dont la propriété est de perdre facilement un ou plusieurs électrons actifs périphériques ;
- les éléments HALOGENES (H) qui, à l´inverse, ont tendance à capturer un ou plusieurs électrons.
Lorsqu´un atome de la première catégorie en rencontre un de la seconde, ils s´échangent tout naturellement un ou plusieurs électrons. C´est le cas d´un atome de Sodium (Na) et d´un atome de Chlore (Cl) qui, en présence l´un de l´autre, deviennent un cation (Na+) et un anion (Cl-). Le champ électrostatique qui se crée entre les deux atomes colle leurs disques de valence externes par une force colombienne (Fi) dite "ionique" évaluée à 98 Kcal/Mol, nettement supérieure à la force d'ancrage (Fa) sensiblement égale à 1 Kcal/Mol.
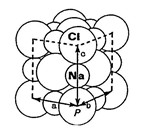
Chlorure de Sodium
Dans le cristal "ionique", les atomes collent leurs disques de valence, sous l´influence de leur force électrostatique (Fi), de telle sorte que les "cations" soient séparés par des "anions". La structure d´un cristal de Chlorure de Sodium est schématisée sur le document précédent où a = b = c = 5,64 Ã ; les axes : a, b et c se rencontrent en "p".
La distance qui sépare le centre de deux atomes de Chlore est légèrement supérieure à la somme des diamètres de chacun des deux ions :
(Cl- = 2 x 1,81) + (Na+ = 2 x 0,95) = 5,52 Ã < a = b = c = 5,64 Ã
Ceci, du fait d'une plus grande répulsion entre les anions de Chlore, plus gros, qu'entre les cations de Sodium, de moindre dimension. D´une façon générale, que les solides soient constitués d'atomes liés par des forces d'ancrage "Fa" ou/et ioniques "Fi", ils ne se structurent jamais en un énorme monocristal, mais en un agrégat de cristaux plus ou moins imbriqués les uns dans les autres, liés par des "ponts" soit neutres dits de "structure", soit "ioniques", si bien que l´ensemble ne présente jamais la dureté d'un cristal idéal.Par exemple, pour le Chlorure de Sodium, le monocristal résiste à une pression de plusieurs centaines de kg/mm2, alors qu´un agrégat des mêmes cristaux se brise à 0,5 kg/mm2.
Ponts "hydrogènes"
Les "Ponts Hydrogène" sont des liaisons de "structure" électrostatiques entre une molécule polaire comprenant un atome d´Hydrogène par exemple -(A – H)+ et une autre molécule polaire comprenant un atome électronégatif (Oxygène : O ; Azote : N ; Fluor : F ; ...) comme, par exemple -(O – B)+
-(A __ H)+ ....... -(O __ B)+
↑
Liaison Hydrogène
L´énergie "Wh" d´une "liaison Hydrogène" varie en fonction des constituants entre 3 et 8 Kcal/Mole. Elle est responsable des points d´ébullition de l´eau et de la structure de la glace.
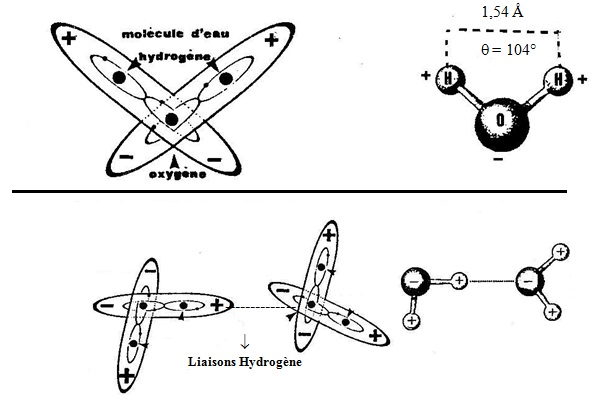
Molécules d´eau :
L´eau, l´élément le plus abondant sur terre, mérite qu´on s´y attarde, car il est indispensable à la vie.
- L´HYDROGENE, univalent, ne peut se lier à un autre ATOME que par une force covalente, selon la Figure n° 90 (page 89) ;
- L´OXYGENE, bivalent, peut, en revanche, se lier à deux ATOMES d´HYDROGENE selon la Figure n° 98 ci-dessous.
Lorsque les conditions de température sont favorables (300 °K) et qu´un ATOME d´OXYGENE heurte successivement deux atomes d´HYDROGENE avec une énergie suffisante, cet ATOME d´OXYGENE peut se combiner, par liaisons covalentes, avec deux ATOMES d´HYDROGENE pour former une molécule d´eau.
Les molécules d´eau, du fait du phénomène d´ionicité, se présentent comme un triangle isocèle au sommet duquel se trouve l´ATOME d´OXYGENE, légèrement négatif, tandis que les deux ATOMES d´HYDROGENE, légèrement positifs, occupent les deux autres côtés.
- Le dessin de gauche est proche de la réalité ;
- Celui de droite est une représentation symbolique souvent utilisée.
Cette nouvelle entité, appelée "eau", est libre de se mouvoir en tous sens. Elle est, entre autres, capable, par liaisons HYDROGENE, de se lier à d´autres molécules identiques dans des structures cristallines (Fi°)
Entre deux molécules d´eau, la liaison hydrogène (voir page 98) est directionnelle : elle s´aligne dans l´axe de la liaison de valence qui lui est associée. Par exemple, dans l´eau, les 3 atomes O, H et O de la liaison O-H......O sont alignés. Cette propriété permet d´avoir des architectures moléculaires très bien définies, comme dans la glace ou dans l´eau à courte distance, ou encore dans les molécules biologiques telles que les protéines, ou l´ADN dont les deux brins sont liés entre eux par liaisons hydrogène.
L´énergie de formation de la liaison hydrogène est de l´ordre des énergies mises en jeu dans les fluctuations thermiques à la température ambiante (27° Celsius). Aussi, de telles liaisons peuvent-elles se tordre, se rompre ou se restaurer à cette température. Cette propriété donne aux architectures moléculaires assemblées par liaisons hydrogène, souplesse et possibilité d´évoluer à la température ambiante, ce que ne peuvent faire les liaisons de valence, beaucoup trop énergétiques et donc complètement rigides à cette même température. Or, cette souplesse et ces possibilités d´évolution sont indispensables aux molécules biologiques.
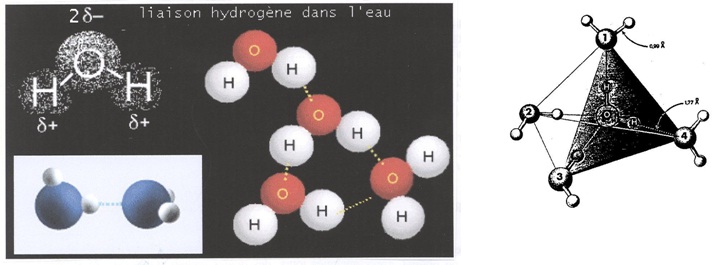
En-dessous de 0 °C, l´agitation thermique diminuant, sous l´action des forces électrostatiques les dimères tendent à s´organiser en un réseau solide à trois dimensions. Lors de la formation de la glace : autour d´une molécule d´eau, quatre autres occupent individuellement l´un des sommets d´un tétraède. Ceci, conformément à la Figure n° 101 où l´on constate que la distance entre le centre du NOYAU de l´ATOME d´HYDROGENE de la molécule marquée zéro et le centre du NOYAU d´OXYGENE de la molécule marquée 4 est égale à 1,77 Å. Cette dimension est celle des liaisons hydrogène
x = 1,77 Å < (1,2 + 0,75 = 1,95 Å)
Dans le milieu non contraignant de l´atmosphère, la symétrie des cristaux élémentaires explique la structure légère et harmonieuse des flocons de neige.
Il est évident que, en-dessous de 0°C, la glace contient de la chaleur. Dans leur structure cristalline, les molécules d´eau vibrent autour de leur position d´équilibre. Si la température ambiante augmente, les molécules périphériques vibrent avec une amplitude croissante. Ces vibrations se communiquent de proche en proche. Certaines molécules se détachent de leurs voisines. Nous appelons cela la fusion. Au contraire, si nous diminuons la température, les vibrations diminuent jusqu´à s´arrêter lorsque la température atteint le zéro absolu.
Propriétés chimiques
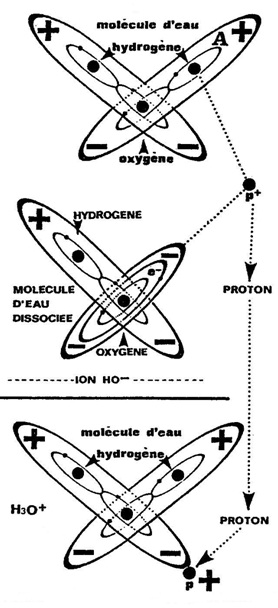
A - Les molécules d´eau (H2O) ont une telle attirance (liaison HYDROGENE) les unes pour les autres qu´il arrive qu´un atome d´HYDROGENE de l´un soit capté par l´atome d´OXYGENE de l´autre.
C´est ce qui se passe sur la Figure n° 102 où la molécule d´eau (A) subit une poussée violente sur l´un de ses atomes d´HYDROGENE dont le NOYAU (PROTON P+) est expulsé et s´éloigne, libre de toute contrainte (Figure n° 103), alors que l´ELECTRON est retenu sur l´orbite de l´OXYGENE en opposition de phase avec le premier. Cette dissociation s´écrit
H2O- → HO- + P+
HO- représente la molécule privée d´un PROTON. Ce dernier généralement ne reste pas longtemps libre :
- soit qu´il se recombine à l´ion HO- pour reformer une molécule d´eau H2O .,
- soit qu´il s´assemble à une molécule d´eau H2O pour former un ion HYDRONIUM H3O+..
B - A 22 °C, dans un kilogramme d´eau pure, on compte 10-7 grammes d´ions HO- et autant d´ions HYDRONIUM H30+. La concentration (Ki) de l´eau en ions HYDRONIUM est exprimée par la relation :
pH = -log Ki ; à 22°C, on a Ki = 10-7 et pH = 7
pH = potentiel Hydrogène = 7 définit la neutralité de l´eau.
C - Réaction avec un acide : Dans l´eau, un acide (H - A) tend à libérer son atome d´Hydrogène mais souvent le choc violent arrache seulement le Proton.
(H2O) + (H - A) ï‚® A- + P+ + H2O → A- + H3O+
Le PROTON ne reste pas longtemps libre et se colle à une molécule d´eau pour former un ion H3O+. La concentration de la solution en ions H3O+ augmente. Si, par exemple, elle atteint la valeur Ki = 10-5 ions gramme par litre
pH = - log Ki = 5 ;
pH = 5 < 7 => solution acide
D - Réaction avec une base : Inversement, une base (B - OH) libère un ion (HO-) dont l´atome d´Oxygène est accompagné d´un électron supplémentaire arraché à la molécule (B).
B+ + (HO-)
L´ion (HO-) se combine au PROTON d´un ion Hydronium (H3O+) pour reconstituer deux molécules d´eau
(HO-) + (H3O+) = 2(H2O)
La concentration en HYDRONIUM (H3O+) diminue. Si, par exemple, elle atteint la valeur 10-8 ions gramme par litre,
pH = - log 10-8 = 8 ; pH = 8 > 7 => solution basique
E - Réaction avec des cristaux de sel : Si, maintenant, nous mettons des cristaux de Chlorure de Sodium (Figure n° 89, page 88) dans de l´eau, les extrémités négatives des molécules d´eau attirent certains "cations" de SODIUM et les extrémités positives attirent des "anions" de CHLORE. En même temps que le sel se dissout dans l´eau, d´autres ions déjà libérés se cristallisent à nouveau. Il y a équilibre lorsque le nombre d´ions qui s´échappent est égal à celui des ions qui se cristallisent.
Si l´on met peu de sel dans l´eau, davantage d´ions se dissocient et le sel se dissout.
Au contraire, si l´eau contient beaucoup de sel dissout, davantage d´ions se soudent et le sel se cristallise.
Si on augmente la température de la solution, le nombre d´ions qui s´échappent augmente et le sel se dissout plus facilement.
L´organisation des atomes au sein de la matière se réalisa selon diverses structures.

